
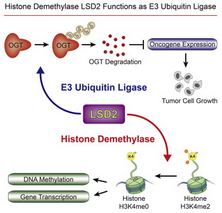
近日,来自复旦大学医学院的徐彦辉研究小组在著名国际期刊molecular cell发表了他们的最新研究进展,他们发现组蛋白去甲基化酶LSD2同时具有E3泛素连接酶活性,LSD2能够依赖其泛素连接酶活性促进O-GlcNAc糖基转移酶降解,从而发挥抗肿瘤功能。
研究人员指出,组蛋白去甲基化酶通过其去甲基酶活性在多种生物学途径中发挥重要作用。但是关于其去甲基酶活性非依赖性的相关研究较少。他们发现,组蛋白H3K4me1/me2去甲基化酶LSD2不仅具有去甲基化酶活性,同时还具有E3泛素连接酶活性。LSD2能够直接对O-GlcNAc糖基转移酶进行泛素化促进其发生蛋白酶体依赖性蛋白降解,并且LSD2能够通过其E3泛素连接酶功能抑制A549肺癌细胞系生长,但这种抑制作用并不依赖于LSD2的去甲基化酶活性。通过基因工程手段删除LSD2能够稳定OGT促进293T细胞的克隆形成。
研究人员发现LSD2能够通过其去甲基化酶活性和E3泛素连接酶功能调控不同靶基因表达。这种调控作用表明LSD2能够通过促进OGT发生蛋白降解抑制肿瘤发生,揭示了LSD2抑制肿瘤发生的新机制,同时LSD2作为E3泛素连接酶,它的其他底物仍有待发现。
综上所述,这项研究揭示了LSD2通过其E3泛素连接酶活性发挥抗肿瘤功能的新机制,并且在组蛋白去甲基化酶和泛素依赖途径之间建立了联系,对细胞内不同生物学途径之间的交叉研究具有重要意义。
原始出处:
Yi Yang, Xiaotong Yin, Huirong Yang, Yanhui Xu.Histone Demethylase LSD2 Acts as an E3 Ubiquitin Ligase and Inhibits Cancer Cell Growth through Promoting Proteasomal Degradation of OGT.Molecular Cell.March 12, 2015.
版权声明:
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







#CEL#
112
#Cell#
57
#去甲基化#
54
#甲基化酶#
99