Nature子刊:科学家从胃干细胞转化出类胰岛β细胞,为糖尿病治疗提供新策略
2023-06-22 楚辞 代谢网 发表于上海
该研究将人类胃干细胞转化为胰岛素样类器官,其含有胃胰岛素分泌(GINS)细胞,分子特征和功能类似于β细胞。
在糖尿病治疗中,胰岛移植是最直接的方案,但其受限于供体不足和免疫排斥等因素而难以推广。因此,产生功能性胰岛素分泌细胞具有巨大的治疗价值。有研究指出,诱导肠道干细胞分化为功能性β样细胞是可行的,然而体内肠道细胞寿命短,且转化效率也不够高,这引起了人们新的思考,是否有更加稳定和持久的方案呢?
2023年4月27日,来自威尔·康奈尔医学院和南京医科大学第一医院的研究团队在国际顶级期刊Nature Cell Biology发表了重要成果,题目为Stomach-derived human insulin-secreting organoids restore glucose homeostasis。该研究将人类胃干细胞转化为胰岛素样类器官,其含有胃胰岛素分泌(GINS)细胞,分子特征和功能类似于β细胞。GINS类器官在10天内获得了葡萄糖刺激的胰岛素分泌,并在移植后恢复了糖尿病小鼠的葡萄糖稳态,且效果维持超过100天,为治疗糖尿病提供了新的希望。

图1 文章首页
研究背景
为什么要选择胃细胞进行研究呢?
首先,从发育角度来讲,因为胃细胞和胰腺细胞在发育的胚胎阶段是相邻的,这使得胃干细胞--胰岛细胞的转化成为可能。
其次,从获取难易程度来讲,通过内窥镜检查获得胃活检以产生自体移植物相对容易,也在很大程度上规避了免疫排斥的影响。
最后,除了自体方法外,仅在美国,每年就进行了超过250,000例减肥手术,其中大部分胃体被切除。这些废弃的组织可以支持胃干细胞生物库的构建,使主要的组织相容性复合体匹配找到合适的移植供体。对于1型糖尿病的治疗,工程免疫逃避类器官可以指导产生在自身免疫环境中存活的GINS类器官。
研究结果
01 GINS类器官的生成
早期实验结果表明,通过激活NPM因子,即3种特定的转录因子Ngn3,Pdx1和Mafa,普通胰腺细胞如腺泡细胞和导管细胞可以转化为分泌胰岛素的β细胞。因此,研究人员从三个转录因子出发,详细评估了可能影响GINS细胞形成的条件,包括NPM表达的时间,培养基组成和其他遗传因素,最后确定了比较合适的方案。
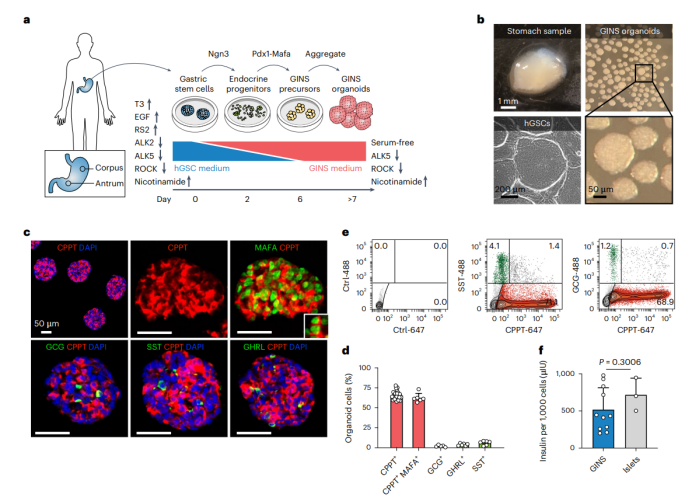
图2 Figure1
02 GINS类器官响应葡萄糖和GLP-1类似物,分泌人胰岛素
GINS类器官在分化后8-10天获得葡萄糖刺激的胰岛素分泌,相比之下,新生的GINS细胞没有或很少有胰岛素分泌(第7天),GINS类器官对反复的葡萄糖刺激有反应。另外,来自两个独立供体的GINS细胞对KCl和利拉鲁肽(一种GLP-3类似物)反应强烈,但对高葡萄糖刺激反应较少,表明它们的功能尚未完全成熟。总之,这些数据建立了一个针对不同供体组织的GINS分化方案,以高效率产生葡萄糖响应类器官。
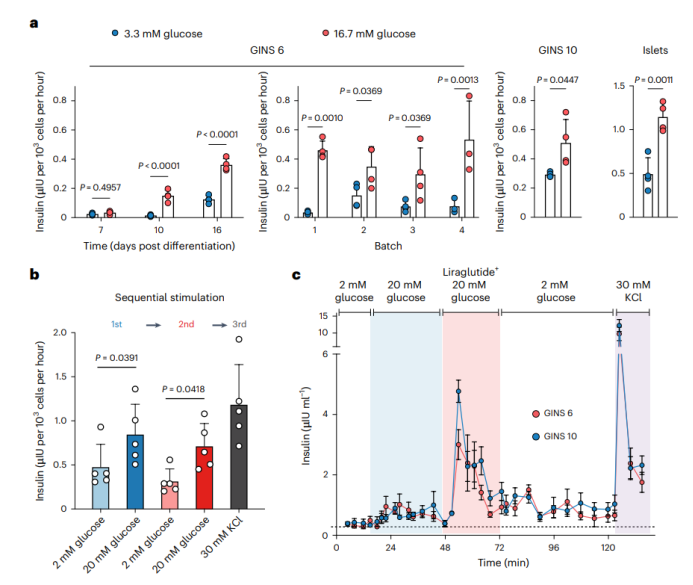
图3 Figure2
03 GINS细胞在植入后持续存在并逆转糖尿病
接下来,为了评估GINS细胞在体内的寿命和功能,研究人员将GINS细胞移植到免疫受损小鼠的肾包膜之下。分别在移植后的2、4和6个月时检查了移植物。大多数GINS移植物显示葡萄糖刺激的胰岛素分泌。同时,研究人员还将6-8万个GINS细胞移植到链脲佐菌素(STZ)诱导的糖尿病小鼠中,发现该移植迅速抑制了小鼠的高血糖并维持葡萄糖稳态超过6天,直到通过肾切除术去除移植物。以上数据说明,源自人类肠道干细胞的GINS细胞可以长寿且功能强大,并且在移植后几乎没有不可控的增殖风险。
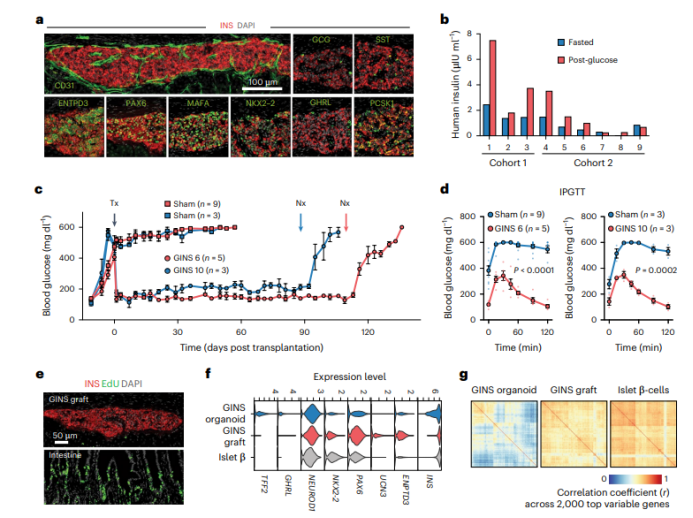
图4 Figure4
结论和展望
本研究主要描述了一种稳健的方案,可以高效地诱导人胃干细胞分化成胰岛素分泌类器官,并恢复了糖尿病小鼠的葡萄糖稳态。
方案的优点主要有:
1. 通过内窥镜检查获得胃活检以产生自体移植物相对容易;
2. GINS类器官生成的三步走方案相对简单;
3. GINS类器官在诱导后10天相对较快地可以进行功能测量;
4. GINS类器官几乎没有致瘤风险;
5. 相同的方案适用于来自不同供体的hGSC;
6. 最后,GINS类器官在移植后效果持续数月。
同时,研究也有局限性。首先,与干细胞来源的胰岛移植物不同,GINS移植物缺乏大量的α样和δ样细胞。这些内分泌细胞群体被认为可以微调β细胞的葡萄糖反应性,它们需要被进一步研究,如有必要,应开发一种新方法来增加α样和δ样细胞的数量。
其次,研究人员配制了一种无血清培养基用于GINS类器官分化,但类器官在体外没有达到完全功能,并且在长时间培养后,它们的葡萄糖反应性减弱。所以,开发一种促进类器官体外成熟的新培养基将是未来研究的重点。
最后,还需要进一步优化才能将GINS技术推向临床,包括用更安全的基因激活方法替代慢病毒感染。
参考文献:Huang, X., Gu, W., Zhang, J. et al. Stomach-derived human insulin-secreting organoids restore glucose homeostasis. Nat Cell Biol 25, 778–786 (2023). https://doi.org/10.1038/s41556-023-01130-y
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













