靶点:c-Met
2023-01-12 精准药物 精准药物 发表于上海
自多激酶抑制剂克唑替尼、卡博替尼之后,c-Met领域频频迎来好消息:2022年12月29日,荣昌生物ADC药物RC108在美国获批临床,治疗实体瘤。
自多激酶抑制剂克唑替尼、卡博替尼之后,c-Met领域频频迎来好消息:2022年12月29日,荣昌生物ADC药物RC108在美国获批临床,治疗实体瘤。2021年06月23日,和黄医药获批国内首个选择性MET抑制剂赛沃替尼。此外,辉瑞、诺华、默克以及恒瑞等大厂都在c-Met领域进行布局。当前, c-Met抑制剂研发热情空前高涨。
到目前为止,针对c-Met抑制剂药物类型多样,涉及小分子抑制剂、单抗、双抗、三抗以及ADC。这些当前非常热门的药物类型,都将c-Met视为一个重要的靶点,足见这一靶点的潜力。那么,c-Met究竟是什么,其背后究竟有什么魔力,为何制药大厂会纷纷押注?
众所周知,肝细胞生长因子受体c-Met/肝细胞生长因子(HGF)信号在癌症进展和侵袭中的作用已被广泛研究。c-Met 为一种受体酪氨酸激酶,可通过与其配体肝细胞生长因子结合后,激活多种不同的细胞信号通路,包括有关增殖、运动、迁移及侵袭的细胞信号通路。
研究表明,c-Met的异常激活可促进多种癌症的发展和进展,具体包括胃癌、肝癌、肺癌、结肠癌、乳腺癌、胰腺癌、卵巢癌、前列腺癌,以及神经系统癌症等。此外,在癌症患者中,c-Met的高表达与不良预后和靶向治疗的耐药性有关。因此,c-Met普遍被认为是治疗多种肿瘤潜在的药物靶点。
c-Met结构及其介导的信号通路
c-Met是位于7号染色体带7q21eq31上的原癌基因,在20世纪80年代中期被鉴定为易位启动子区(TPR)-Met融合癌基因。c-Met是由MET基因编码产生的具有自主磷酸化活性的跨膜受体,属于酪氨酸激酶受体家族,由跨膜β链(145 kDa)和细胞外α链(50 kDa)组成。c-Met基因全长125 kb,有21个外显子(图1)。

图1.c-Met的结构特征
HGF,也被称为分散因子(SF),是目前已知的唯一与C-Met具有高亲和力的天然配体,于20世纪80年代被发现。C-Met与HGF的结合导致细胞内激酶结构域的c-MET二聚和酪氨酸残基的反式磷酸化,随后在MET结合结构域内的酪氨酸残基进一步磷酸化。这种自磷酸化过程导致信号效应物如生长因子受体结合蛋白2(GRB2)和GRB2相关接头蛋白1(GAB1)的招募,进而激活下游信号通路,如Ras/Raf/MEK/MAPK、Ras/PAK、SRC、FAK、JAK/STA T、Wnt/β-catenin和PI3K/Akt/mTOR通路。而下游信号转导的催化激活,调控细胞周期、存活、增殖、运动、侵袭、抗凋亡作用、上皮细胞-间充质转化(EMT)和血管生成等多种细胞过程(图2)。
研究发现,在不同类型的肿瘤中均观察到异常的c-Met调控,包括胃肠道(GI)癌,肝细胞癌(HCC)和非小细胞肺癌(NSCLC)。通常,异常激活可通过c-Met过表达、基因组重排(易位、扩增和突变)来实现。此外,HGF/c-Met信号通路还可以与其他酪氨酸激酶RTK介导的信号通路表现出显著的交叉作用,以促进肿瘤发生和靶向治疗耐药性的产生。
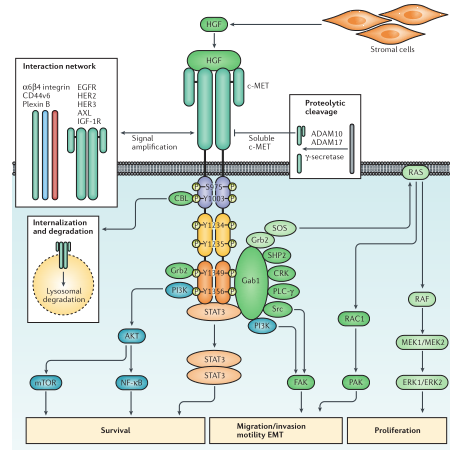
图2.c-Met介导的信号通路
针对HGF/c-Met信号通路的研究策略
目前,针对HGF/c-Met信号通路主要通过两种不同的策略来实现。第一种策略是开发抑制HGF/c-Met相互作用或抑制c-Met二聚的单克隆抗体(mAbs)。第二种策略是通过开发c-Met小分子激酶抑制剂,它通过针对受体的细胞质结构域的激活位点,阻止其磷酸化和下游信号(图3)。
抗Met单克隆抗体根据作用靶标进一步分类,分为与配体HGF结合的单抗和与受体c-Met结合的单抗。目前,研究人员也开发了针对c-Met的其他抗体类药物,如:双抗、单抗、以及ADC药物等。
目前,针对c-Met激酶的小分子抑制剂主要分为三类:I类和II类都被称为三磷酸腺苷(A TP)竞争性抑制剂,因为它们是A TP的类似物,是c-Met酪氨酸激酶磷酸化的底物。I类和II类抑制剂之间的区别在于它们与c-Met的结合方式。
I类抑制剂特异性结合到c-Met的ATP结合位点,通常通过与残基Met1160的氢键结合。因此,I类抑制剂比II类抑制剂具有更高的选择性。代表药物为:卡马替尼、特泊替尼。
II类抑制剂是多靶向激酶抑制剂,通常采用包含额外残基的扩展构象,这通常会导致具有高分子量和高亲脂性的化合物。代表药物为克唑替尼、卡博替尼。
III类c-Met抑制剂是非典型的非ATP竞争性小分子抑制剂。代表药物为tivantinib。遗憾的是,tivantinib在原发性肝癌III期临床试验中未能达到主要终点,患者整体生存率未见明显提升,目前已终止临床。

图3.针对HGF/c-Met信号通路的研究策略
c-Met抑制剂研究现状
目前,针对c-Met主要包括小分子TKIs和抗体类大分子药物(图4)。其中小分子TKIs可分为多激酶抑制剂和单靶点高选择性抑制剂,前者包括克唑替尼、卡博替尼,后者包括特泊替尼、赛沃替尼、卡马替尼等。其中,卡马替尼是首款获FDA批准的c-Met抑制剂。
而针对c-Met大分子药物主要包括复宏汉霖的c-Met单抗,强生的靶向EGFR×c-Met双抗药物Rybrevant以及嘉和生物EGFR×cMet×cMet三抗药物。此外,荣昌生物和恒瑞医药靶向c-Met的ADC药物也相继进入临床实验。值得注意的是,获批的适应症集中于非小细胞肺癌。
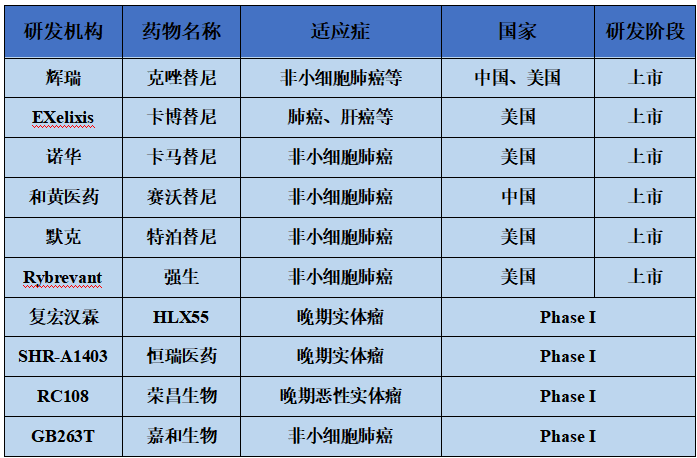
图4.代表性c-Met抑制剂在研情况
1
c-Met小分子抑制剂
(1)c-Met的多靶点抑制剂
克唑替尼和卡博替尼属于多靶点的c-Met抑制剂(图5)。克唑替尼(Crizotinib)是一种由辉瑞公司华人科学家崔景荣研发的,作用于c-Met和ALK双靶点的c-Met抑制剂类抗肿瘤药物。卡博替尼是一个多靶点抗肿瘤药物,有9个以上的靶点,包括RET、ROS1等。
而多靶点c-Met抑制剂能够靶向多个激酶,它们的VEGFR活性远高于Met活性,对于Met致癌突变的靶向干预却较为困难。单靶点c-Met抑制剂能够结合在Met较为独特的铰链区域,高选择性抑制Met激酶。出于对多靶点药物活性平衡及安全性方面考虑的缘故,目前针对c-Met抑制剂的研发主要集中在单靶点抑制剂的开发。
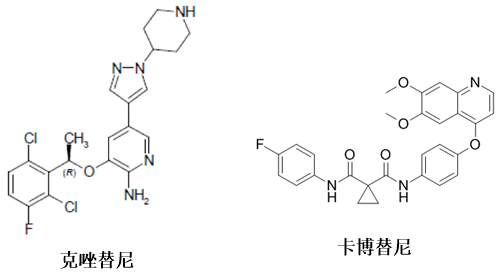
图5. 多靶点c-Met抑制剂
(2)c-Met的单靶点抑制剂
诺华研发的卡马替尼是首款获FDA批准的c-Met抑制剂,于2020年5月获FDA 批准上市,用于治疗MET exon14突变的NSCLC患者。
赛沃替尼由和黄医药研发,是我国首个获批的特异性靶向MET激酶的小分子抑制剂。2021年6月,赛沃替尼获批上市,用于治疗MET 14号外显子跳变的局部晚期或转移性NSCLC成人患者。
特泊替尼由默克研发,是一款口服c-Met抑制剂,用于治疗携带Met外显子14跳跃突变的NSCLC患者(图6)。
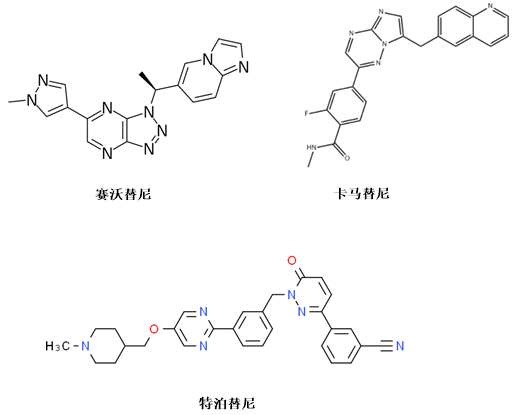
图6.单靶点c-Met抑制剂
2
c-Met的单克隆抗体
c-Met作为跨膜蛋白,其介导的内吞机制也为抗体类药物开发提供了机会。并且,靶向c-Met单抗药物的选择性强,安全性优势明显。
HLX55是复宏汉霖旗下一款针对c-MET靶点开发的人源化单克隆抗体,目前处于临床Ⅰ期。2019年10月,HLX55用于转移性或复发性实体瘤治疗的临床试验申请获NMPA批准。HLX55在一项在标準疗法难治的晚期实体瘤受试者中进行的1期试验中显示了良好的安全性及耐受性。
3
c-Met的双特异性抗体
Rybrevant是美国强生公司研发的一款靶向EGFR/c-Met的双特异性抗体,于2021年5月获FDA批准上市,用于治疗铂类化疗后进展的EGFR外显子20插入突变的转移性非小细胞肺癌(NSCLC)患者(图7)。
Rybrevant一方面可以抑制EGFR和c-Met信号通路,另一方面它也可以降解EGFR和c-Met受体。此外,Rybrevant的 Fc端介导的ADCC(抗体依赖细胞介导的细胞毒性作用)作用,招募免疫细胞,启动免疫反应从而杀死肿瘤细胞。

图7. 靶向c-Met/EGFR的双特异性抗体Rybrevant
4
c-Met的ADC药物
恒瑞医药的SHR-A1403是国内首个进入临床阶段的c-Met 抗体偶联在研新药,也是国内第一个获得FDA临床批准的抗体偶联药物。SHR-A1403由抗c-Met的人源化IgG2单克隆抗体与细胞毒素微管蛋白抑制剂偶联而成。
另一个靶向c-Met的ADC药物是荣昌生物研制的RC108,适应症为c-Met阳性晚期恶性实体瘤。RC108具备较好的稳定性以及靶点亲和力。2020年11月,NMPA批准了RC108的IND申请,目前处于Ⅰ期临床。
2022年12月29日,荣昌生物研制的c-Met ADC RC108获得FDA临床试验许可,在c-Met表达阳性的实体瘤患者中开展临床研究。
5
c-Met的三抗药物
嘉和生物的GB263T是一款针对EGFR和两个cMet不同表位的三特异性抗体,可同时抑制原发性及继发性EGFR突变和cMet信号通路,下调EGFR与cMet蛋白表达水平,并有效诱导EGFR及cMet的内吞。
2022年3 月 29 日,CDE 官网显示,嘉和生物注射用GB263T首次申报临床。这是一款 EGFR/c-Met/c-Met 三特异性抗体,适应症为非小细胞肺癌(NSCLC)。此外,GB263T 也是全球首个 EGFR/c-Met/c-Met 三特异性抗体。
— 小结 —
研究表明,HGF/c-Met通路在癌症中起着关键作用,在多种恶性肿瘤中是一个有吸引力的治疗靶点。在过去的十年中,人们致力于开发新的选择性靶向c-Met抑制剂,无论是小分子药物还是抗体类药物,这些抑制剂都已经显示出有意义的显著的临床疗效。
然而,由于c-Met基因的扩增和过表达、c-Met突变以及旁通路激活等耐药机制的出现,目前临床上使用的c-Met抑制剂不可避免出现了获得性耐药等问题。此外,也有研究表明,c-Met抑制剂(克唑替尼、卡博替尼等)也存在许多严重的不良反应。因此,如何克服c-Met抑制剂的获得性耐药以及提高安全性是接下来c-Met抑制剂首要解决的问题。此外,基于PROTAC技术在克服耐药性方面的重要优势,c-Met的降解剂的开发或许为c-Met领域的研发提供了新思路。
参考文献:
1.Safety and Tolerability of c-MET Inhibitors in Cancer. doi:10.1007/s40264-018-0780-x
2.Recent advances in the discovery of small molecule c-Met Kinase
Inhibitors. European Journal of Medicinal Chemistry 143 (2018) 1103e113 8
3.Small-molecule kinase inhibitors: an analysis of FDA-approved drugs, Drug Discov. Today 21 (2016) 5e10, https:// doi.org/10.1016/j.drudis.2015.07.008.
4.c-Met as a potential therapeutic target and biomarker in cancer, Ther. Adv. Med. Oncol. 3 (2011) S21eS35, https://doi.org/10.1177/1758834011422557.
5.靶向c-Met药物在研现状. bioSeedin柏思荟
6.MET: a critical player in tumorigenesis and therapeutic target, Cold Spring Harb, Perspect. Biol. 5 (2013) a009209, https://doi.org/10.1101/cshperspect.a009209.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言