Cell 综述:解密复杂性状的遗传与分子基础
2024-03-07 生物探索 生物探索 发表于上海
随着遗传学研究的不断深入和技术的不断进步,我们对人类遗传信息的理解将更加深刻,有望在未来解开更多生命科学的谜题,为人类健康和疾病的治疗带来革命性的进展。
引言
人类遗传学,作为生物学的一个分支,专注于研究基因如何在不同代之间传递以及这些基因如何影响个体的性状和疾病。自遗传学诞生之日起,其发展历程便充满了创新与突破。从孟德尔的豌豆实验,到沃森和克里克发现DNA的双螺旋结构,再到人类基因组计划的完成,每一步都极大地推进了我们对人类遗传信息的理解。
随着技术的进步,尤其是高通量测序技术的发展,人类遗传学进入了一个全新的时代。这些技术的应用不仅加速了新基因的发现,还使我们能够深入探究基因变异与复杂性状之间的关系,揭示了遗传多样性的真实面貌。
复杂性状,如身高、智力和多数疾病的发生,通常不由单一基因控制,而是多个基因以及环境因素共同作用的结果。近年来,随着遗传学研究的不断深入,我们已经开始理解到,复杂性状的遗传背景远比预想中要复杂。
通过全基因组关联研究(GWAS)和其他遗传学研究方法,研究人员已经成功地鉴定出数千个与人类复杂性状相关联的遗传变异。这些研究不仅增加了我们对特定性状遗传基础的了解,还帮助我们认识到遗传变异如何通过影响分子和细胞层面的机制,进而影响整个生物体的功能和健康状况。
人类遗传学的未来发展方向将更加侧重于解析复杂性状的分子机制,探索遗传变异如何通过影响基因表达、蛋白质功能以及细胞信号传递等过程,最终导致复杂性状的形成。此外,随着个性化医疗的兴起,如何将遗传学研究成果应用于疾病的预防、诊断和治疗,也是未来研究的重要方向。2月29日Cell杂志综述“Genetic and molecular architecture of complex traits”对此也展开了详细的讨论。随着遗传学研究的不断深入和技术的不断进步,我们对人类遗传信息的理解将更加深刻,有望在未来解开更多生命科学的谜题,为人类健康和疾病的治疗带来革命性的进展。

近年来的关键进展
遗传变异的广泛图谱:通过全基因组测序(Whole Genome Sequencing, WGS)项目,如1000 Genomes Project,现在能够更全面地理解人类遗传多样性。揭示了大量的单核苷酸变异(Single Nucleotide Variants, SNVs)和其他遗传变异类型,如拷贝数变异(Copy Number Variants, CNVs)。
复杂性状的遗传架构:对于复杂性状(如身高、智力等)的遗传基础的理解已经从简单的几个基因,扩展到涉及数千甚至数百万个遗传变异的高度多基因(polygenic)模型。这种复杂性状的多基因性(polygenicity)和遗传异质性(heterogeneity)的认识,推动了对大型生物样本库(biobanks)的利用,以进行关联分析。
表型关联研究(Phenome-Wide Association Studies, PheWAS):PheWAS技术允许研究者人员探索特定遗传变异与多种疾病和性状之间的关联,有助于揭示遗传变异的多重效应(pleiotropy)和复杂的疾病机制。
转录组关联研究(Transcriptome-Wide Association Studies, TWAS):TWAS技术使研究者能够利用遗传信息预测基因表达水平,并将这些预测与疾病风险关联起来,揭示了基因表达调控在疾病中的作用。
单细胞测序技术(Single-Cell Sequencing):单细胞测序技术的应用提供了在个体细胞水平上理解遗传变异效应的新途径,使得可以精确地识别特定细胞类型和状态中的分子和遗传调控机制。
多群体遗传分析:通过比较不同种群的遗传数据,研究人员能够识别那些对于疾病具有不同贡献的遗传变异,这有助于理解疾病在不同人群中的异质性和共性。
罕见变异的作用:随着测序技术的进步和样本量的增加,罕见变异对复杂性状和疾病风险的贡献变得越来越受到关注。这推动了对罕见变异的系统研究,以及它们在遗传结构和功能中的作用。
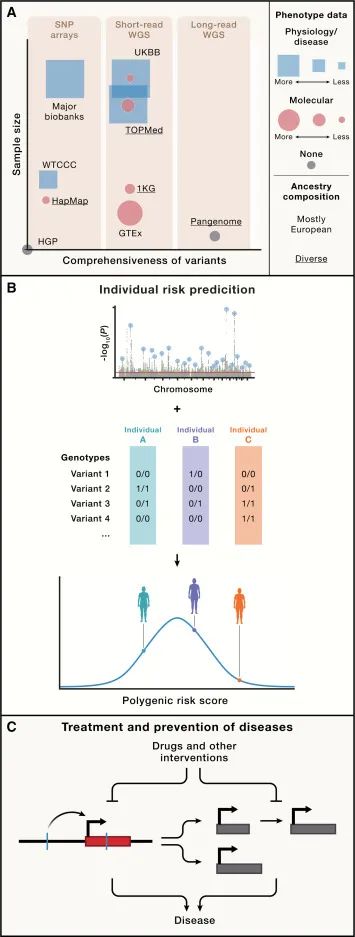
人类遗传学研究的数据集和动机(Credit: Cell)
现代人群遗传变异的起源与模式
遗传变异构成了生物多样性的基础,是进化的直接证据。在人类遗传学领域,理解现代人群遗传变异的起源与模式对于揭示人类演化历史、疾病易感性及复杂性状的形成至关重要。
遗传变异的起源
人类遗传变异的起源可追溯至数百万年前。随着人类从非洲迁徙至全球各地,自然选择、基因流动(gene flow)和遗传漂变(genetic drift)共同作用于人群,导致了遗传变异的累积和分化。这些遗传变异不仅记录了人类的迁徙路线,也反映了人类在面对不同环境压力时的适应性进化。
遗传变异的模式
全球人群的遗传多样性: 研究表明,尽管所有人类之间的遗传差异相对较小,但仍存在显著的地理模式。非洲人群展现出最高的遗传多样性,这与人类起源于非洲的假设相一致。
遗传变异与疾病关联: 特定地理区域的人群可能会发展出对当地环境压力的适应性变异,如高海拔地区居民对低氧环境的适应性变异。这些局部适应性变异有时也与疾病易感性相关联。
中性变异与选择性“扫荡”: 许多遗传变异是中性的,即它们对个体的生存和繁殖没有直接影响。然而,一些变异会受到正向选择,导致某些基因在人群中频率的快速增加,这一过程称为选择性“扫荡”。
遗传变异的现代模式
在现代社会,人类遗传变异的模式受到了迁徙、城市化和文化交流等因素的深刻影响。全球化促进了不同人群之间的基因流动,可能导致遗传多样性的增加。同时,现代医疗和公共卫生措施改变了自然选择的压力,这可能影响未来人类遗传变异的方向。
人类疾病与性状的遗传架构
在探讨人类疾病与性状的遗传架构时,我们不可避免地会触及到遗传多样性与复杂性状之间的深层联系。这一领域的研究旨在解析特定遗传变异如何影响人类健康状态与生理性状,从而揭示疾病发生的遗传基础。
遗传架构
遗传架构指的是特定性状或疾病背后的遗传基础,包括影响该性状的所有遗传变异及其作用方式。这些变异可能包括单个核苷酸多态性(SNPs)、插入缺失变异(Indels)、拷贝数变异(CNVs)等,它们通过影响基因表达、蛋白功能或细胞信号传递等多种机制,共同作用于性状的表现。
复杂性状的多基因性
大多数人类性状和疾病不是由单一基因决定的,而是多基因和环境因素共同作用的结果。这种复杂性状的遗传架构通常呈现高度的多基因性和多态性。例如,身高、体重、心血管疾病和多种精神疾病的遗传倾向,都是由数十上百个小效应遗传变异累积作用的结果。
遗传与环境的相互作用
在人类疾病与性状的遗传架构中,遗传与环境的相互作用是一个不容忽视的重要因素。某些遗传变异可能在特定环境条件下才表现出其影响,或者环境因素可能改变遗传倾向的表达。例如,吸烟行为与某些肺癌相关遗传变异的相互作用显著增加了肺癌的风险。
疾病易感性的遗传标记
通过全基因组关联研究(GWAS)等方法,研究人员已经成功鉴定出数以千计与各种疾病和性状相关的遗传标记。这些遗传标记不仅增进了我们对疾病遗传基础的理解,也为疾病的早期诊断、预防和个性化治疗提供了可能。
遗传变异的分子与细胞效应
在探究复杂性状背后的遗传机制时,遗传变异对分子和细胞层面的影响是研究的核心。这些效应揭示了基因如何通过影响特定的分子通路和细胞功能来控制性状的表达。
遗传变异与基因表达
基因表达的调控是一个复杂的过程,涉及多个步骤,包括转录、mRNA处理、翻译和蛋白质修饰。在这一过程中,转录因子、增强子、抑制子以及其他非编码RNA等元素起到了关键作用,它们可以正面或负面地影响基因的表达水平。
遗传变异主要分为两类:序列变异和结构变异。序列变异包括单核苷酸多态性(SNPs)、插入和缺失(Indels),而结构变异则包括拷贝数变异(CNVs)、倒位、易位和大片段的插入或缺失。这些变异通过改变基因序列或基因表达调控元件,进而影响基因表达的水平和模式。
遗传变异对基因表达调控的具体影响
转录层面:遗传变异可以改变转录因子的结合位点,增强或抑制转录过程。
mRNA处理:变异可能影响剪接位点,导致异常的mRNA剪接形式。
翻译层面:变异可以影响mRNA的翻译效率或蛋白质的稳定性。
遗传变异对蛋白功能的影响
错义变异:这些变异改变了编码蛋白质的氨基酸序列,可能导致蛋白质功能失活或功能改变,进而影响细胞的生理状态。
同义突变:虽然这类变异不改变蛋白质的氨基酸序列,但可能影响蛋白质的表达水平或稳定性,对细胞功能产生影响。
细胞信号传导的调节
遗传变异可以通过影响细胞内的信号传导网络来控制细胞的行为和命运。例如,特定的变异可能激活或抑制信号通路,导致细胞增殖、分化或凋亡的改变,这些过程在癌症和其他疾病中至关重要。
遗传变异与细胞环境的互作
基因-环境相互作用:遗传变异的效应可能受到外部环境因素的影响,如饮食、生活方式和环境污染等,这些相互作用对于个体健康和疾病易感性具有深远影响。
微环境变异:细胞周围的微环境,包括细胞间通信、局部生长因子和细胞外基质,也受到遗传变异的影响,这对组织发育和疾病进程至关重要。
molQTL研究的发展
分子数量性状位点(molQTL)研究,是通过量化遗传变异对基因表达、蛋白质水平或其他分子表型影响的科学研究。这项研究的快速发展,为理解遗传变异如何通过分子机制影响复杂性状和疾病提供了突破口。随着高通量测序技术和生物信息学分析方法的进步,molQTL研究已能在全基因组层面揭示成千上万的关联,这些发现极大地丰富了我们对遗传调控网络的认识。
eQTL研究:表达型数量性状位点(eQTL)研究是molQTL领域的一个重要分支,它关注遗传变异如何影响基因表达。这些研究表明,大量的遗传变异通过调控基因表达水平来发挥作用,进而影响个体的表型和疾病风险。
splicing QTL(sQTL)研究:随着研究的深入,研究人员也开始关注遗传变异对RNA剪接过程的影响,即sQTL研究。这些研究揭示了遗传变异如何通过改变mRNA的剪接方式影响蛋白质的功能,从而参与复杂性状的形成。
molQTL研究不仅揭示了遗传变异的分子效应,也为深入理解疾病的分子机制提供了新视角。通过结合GWAS发现的疾病相关遗传变异和molQTL数据,研究人员能够识别出疾病过程中关键的分子路径和调控网络。
疾病机制的揭示:例如,在某些自身免疫疾病的研究中,通过eQTL分析发现,与疾病风险相关的遗传变异经常影响免疫细胞中的基因表达。这类发现帮助研究人员构建了疾病发展的分子模型,指出了潜在的治疗靶点。
药物靶点的发现:molQTL研究还可以揭示已知药物靶点的遗传调控机制,为开发新药和个性化医疗策略提供依据。例如,通过分析与药物反应相关的遗传变异的eQTL效应,可以预测个体对特定药物的反应性。
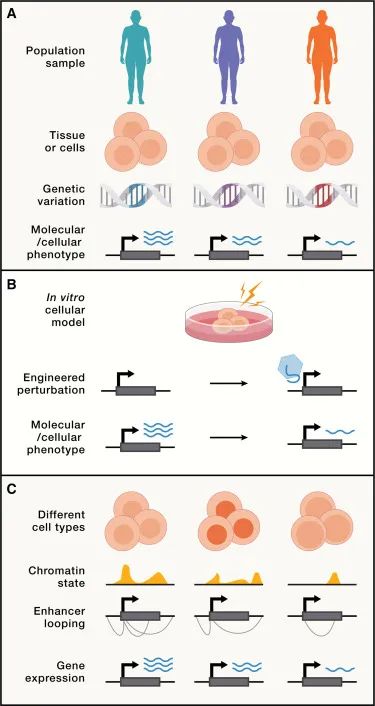
理解遗传变异的分子效应的方法(Credit: Cell)
遗传变异影响的细胞活动
遗传变异对细胞活动的影响是现代分子生物学与遗传学研究的热点之一。这些变异如何干预细胞的正常功能,促进或抑制疾病的发展,是研究人员试图解答的核心问题。
细胞增殖与遗传变异
细胞增殖是维持生命过程的基础,遗传变异可能通过影响细胞周期调控蛋白的表达或活性来促进或抑制细胞的增殖。例如,特定的基因变异可能导致肿瘤抑制基因的失活或癌基因的激活,从而导致细胞增殖失控,最终促进肿瘤的形成。
肿瘤抑制基因的失活:如TP53基因的突变,可能导致细胞对DNA损伤的响应减弱,增加细胞癌变的风险。
癌基因的激活:如RAS基因的突变,可增强细胞增殖信号,促进肿瘤生长。
细胞分化与遗传变异
细胞分化是多细胞生物发育的关键过程,遗传变异可以影响细胞命运的决定和分化过程。这类变异可能通过改变信号传导路径或转录因子的功能,影响特定细胞类型的形成。例如,某些基因变异可能导致干细胞分化异常,进而影响组织的再生能力或形成发育异常。
细胞凋亡与遗传变异
细胞凋亡是一种程序化的细胞死亡过程,对维持组织稳态和防止疾病发展至关重要。遗传变异可能通过影响凋亡信号通路来抑制或促进细胞死亡。例如,BCL-2家族蛋白的变异可能干扰凋亡过程,导致细胞异常存活,这是许多类型肿瘤的特征之一。
遗传变异与疾病的关联
遗传变异对细胞程序的影响揭示了它们在多种疾病中的作用机制,包括但不限于癌症、神经退行性疾病和发育异常。通过深入理解这些变异如何调控细胞程序,研究人员可以设计出针对特定分子靶点的治疗策略,为患者提供更有效的治疗选项。
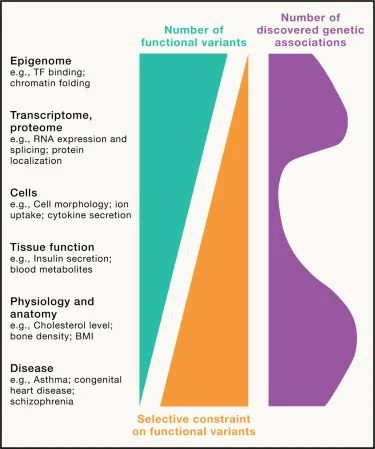
不同水平上遗传变异的影响(Credit: Cell)
遗传变异与复杂性状的关联
全基因组关联研究(GWAS)已成为揭示遗传变异与复杂性状之间关系的重要手段。通过分析成千上万个样本的遗传数据,GWAS能够发现那些与人类的身高、体重、疾病易感性等性状相关的遗传标记。近年来,随着测序技术的发展和数据处理能力的提高,GWAS已成功鉴定出数千个与复杂性状相关的遗传位点。然而,这一进展也伴随着诸多挑战,例如:
多样性不足:大多数GWAS研究集中在欧洲血统的人群上,这限制了研究结果的普适性和在其他族群中的应用。
遗传效应小:大多数与性状相关的遗传变异对性状的影响相对较小,这需要极大的样本量来确保统计上的发现是可靠的。
生物机制不明:即使某个遗传变异被确认与特定性状相关,其背后的生物学机制往往仍然是未知的。
多基因风险评分的应用和限制
随着GWAS发现的遗传变异数量不断增加,多基因风险评分(PRS)成为了一种将遗传信息用于疾病风险预测的方法。通过综合考虑多个遗传变异对特定疾病或性状的贡献,PRS旨在为个体提供更精准的疾病风险预测。该方法在一些疾病的风险预测中显示出了潜力,例如心血管疾病和某些类型的癌症。然而,PRS的应用也面临着限制:
人群特异性:不同人群的遗传背景差异导致PRS的预测效果在不同族群中有所不同,特别是对于非欧洲血统的人群,现有的PRS模型可能不够准确。
环境因素的影响:PRS主要关注遗传因素,而忽视了环境因素和遗传与环境的相互作用对疾病风险的影响。
疾病预测的局限性:尽管PRS在某些疾病的风险评估中表现出潜力,但对于复杂性状而言,仅依赖PRS进行预测仍然是有限的。
统计方法与技术进步对遗传学研究的推动
在遗传学研究的浪潮中,统计方法和技术进步起到了推波助澜的作用,特别是在复杂性状的遗传架构研究领域。随着科学技术的不断进步,我们对遗传信息的理解也日益深入,这一切都离不开先进的统计方法和技术工具的支撑。
统计遗传学的兴起
遗传关联分析:通过比较患病个体与健康对照组的遗传变异,统计遗传学能够揭示与特定疾病相关联的遗传标记。这种方法依赖于复杂的统计模型,用以处理大规模数据集中的变异性。
多变量分析:为了理解多个遗传变异与复杂性状之间的关系,研究人员采用多变量分析技术,这些技术能够揭示不同遗传标记之间的相互作用以及它们如何共同影响性状的表达。
NGS技术
全基因组关联研究(GWAS):利用下一代测序技术,GWAS能够在全基因组范围内识别与复杂性状相关的遗传变异。这种方法极大地加速了遗传变异的发现过程,推动了遗传学研究的发展。
单细胞测序:单细胞测序技术的应用让研究人员能够在单个细胞水平上理解遗传变异的影响,这对于揭示细胞异质性和复杂疾病的分子机制具有重要意义。
大数据与机器学习
生物信息学:随着遗传数据的爆炸式增长,生物信息学成为处理和分析大规模遗传数据不可或缺的工具。这包括从海量数据中提取有用信息、建立预测模型以及识别遗传和表型之间的关联。
机器学习在遗传学中的应用:机器学习技术,特别是深度学习,正在遗传学研究中发挥越来越重要的作用。它们能够从复杂的遗传数据中学习模式,预测遗传变异对性状的影响,以及揭示未知的生物学机制。
遗传数据的扩展和多样性的重要性
随着遗传学研究的深入发展,研究人员逐渐认识到,遗传数据的多样性对于深入理解人类疾病的遗传基础至关重要。尤其是在全球化的背景下,包含更多非欧洲血统人群的遗传数据对于提升研究的普适性和精确性具有不可替代的作用。
目前,大多数遗传学研究和全基因组关联研究(GWAS)主要集中在欧洲血统的人群上,这一偏向导致了研究结果的局限性和应用范围的限制。多样化的遗传数据不仅可以促进全人类共有的遗传特征的发现,还能揭示特定族群特有的遗传标记和疾病易感性。因此,积极扩展研究范围,纳入更多非欧洲血统人群的遗传数据,对于提高研究的代表性和推广精准医疗具有重要意义。
强化遗传关联研究的普适性
揭示特定人群的遗传多样性
提高疾病风险预测的准确性
稀有变异对复杂性状的影响
在遗传研究中,稀有变异的角色逐渐受到重视。尽管这些变异在人群中的频率较低,但它们可能对个体的性状和疾病风险具有重要影响。通过扩展遗传数据的多样性,研究人员能够更加精确地识别稀有变异,并理解这些变异如何在不同人群中发挥作用。此外,研究稀有变异还有助于:
揭示复杂性状的遗传机制
识别新的疾病相关基因
为罕见病的诊断和治疗提供线索
稀有变异的研究不仅拓宽了我们对遗传多样性的认识,也为遗传疾病的预防、诊断和治疗开辟了新的途径。因此,加强对稀有变异的研究,特别是在多样化的人群中进行这一研究,对于推动遗传学和医学的发展至关重要。
遗传学在社会和医疗中的应用
遗传学的快速进展不仅推动了科学界的发展,也对社会和医疗领域产生了深远的影响。随着遗传学研究的深入,遗传风险预测变得更加精确。这一进展对于早期诊断、疾病预防以及治疗策略的选择具有重要意义。
全基因组关联研究(GWAS):GWAS能够识别与特定疾病相关的遗传变异,为遗传风险评估提供了基础。通过分析大量个体的基因组数据,研究人员可以预测个体对某些疾病的易感性。
多基因风险评分(Polygenic Risk Scores,PRS):PRS结合多个遗传标记的风险,为个体提供一个综合的遗传风险评分。这种方法可以用于预测多种疾病的风险,包括心血管疾病、某些类型的癌症以及精神障碍等。
促进个性化医疗和药物发展
遗传学的应用不仅限于疾病风险的预测,还包括个性化医疗和药物的发展。
个性化医疗:遗传信息的利用使得医生能够根据患者的遗传背景制定个性化的治疗方案。例如,基于患者的遗传变异情况,医生可以预测患者对特定药物的反应,从而选择最有效的治疗方法。
药物发展:遗传学研究有助于新药的开发,特别是在针对特定遗传变异引起的疾病方面。通过理解疾病的遗传基础,研究人员可以设计出靶向特定分子途径的药物,提高治疗效果,减少不良反应。
面临的挑战和机遇
数据的复杂性与解析难度
遗传数据的复杂性极高,包含来自数亿个基因位点的信息。如何准确解析这些数据,特别是在考虑到环境因素和基因间相互作用时,仍然是一个巨大的挑战。此外,数据的解析需要强大的计算资源和先进的算法。
遗传多样性的包容性
目前的遗传研究大多集中在欧洲血统的人群上,这限制了我们对全人类遗传多样性的理解。为了提高遗传研究的普适性和应用范围,需要扩大样本的种族和地理覆盖范围。
遗传信息的隐私和伦理问题
随着遗传学在医疗和商业领域的应用日益增加,如何保护个人的遗传信息安全、避免信息滥用成为了重要议题。此外,遗传筛查和编辑技术的伦理问题也需要社会各界共同面对和解决。
疾病预防和治疗的新途径
遗传学的进步为疾病的预防和治疗提供了新的途径。通过理解遗传变异如何影响疾病风险,可以开发出更为精确的预防策略和个性化治疗方案。
个性化医疗的推广应用
遗传信息的利用有助于实现真正的个性化医疗。这不仅能提高治疗效果,减少不必要的副作用,还能优化医疗资源的分配,提高医疗服务的效率和质量。
增强公众健康意识和教育
随着遗传学知识的普及,公众对遗传健康的意识将逐渐增强。这不仅有助于提高人们的健康生活水平,也为未来的遗传学研究和应用创造了良好的社会环境。
Q&A
什么是多基因风险评分(PRS)?
多基因风险评分(PRS)是一种通过分析个体基因组中多个遗传变异来预测该个体对某一疾病或特征的易感性的方法。它通过综合考虑成千上万个小效应遗传变异的累积影响,为个体提供一个量化的风险评估。PRS的开发和应用,是个性化医疗和精准医疗领域的重要进展之一,能够帮助医生和研究者更好地理解个体间在疾病风险上的差异。
遗传多样性如何影响疾病风险预测?
遗传多样性是指在特定人群中遗传变异的范围和频率。这种多样性对疾病风险预测至关重要,因为不同的遗传背景可能导致疾病风险的差异。通过分析遗传多样性,研究人员能更准确地识别疾病相关的遗传标记,从而为不同人群提供个性化的风险评估和预防策略。
GWAS研究中存在的主要挑战是什么?
全基因组关联研究(GWAS)是一种用于识别与特定疾病相关的遗传变异的方法。GWAS面临的主要挑战包括但不限于:
样本大小:需要大量样本来确保统计功效,发现小效应大小的变异。
多重检验:进行成千上万次比较时,控制假阳性率变得复杂。
遗传异质性:同一疾病可能由不同的遗传变异在不同人群中引起。
环境因素:环境和生活方式的因素也会影响疾病风险,与遗传因素相互作用。
单细胞技术如何改变我们对遗传变异影响的理解?
单细胞技术通过在单个细胞水平上分析基因表达和细胞状态,提供了前所未有的分辨率和精度,从而极大地增强了我们对遗传变异如何影响细胞功能和生物过程的理解。这种技术使得研究人员能够识别出在组织或疾病状态中存在的细胞异质性,揭示细胞间差异的遗传基础。单细胞技术在癌症研究、发育生物学以及免疫学等领域展现了巨大潜力,为揭示复杂生物过程提供了新的视角。
遗传学如何帮助发展个性化医疗?
个性化医疗旨在根据个人的遗传信息、生活方式和环境因素定制医疗方案。遗传学通过识别与特定疾病相关的遗传变异,为个性化医疗提供了科学基础。这包括:
风险评估:基于个人的遗传信息评估其对特定疾病的易感性。
药物基因组学:根据个人的遗传变异选择最有效且副作用最小的药物和剂量。
早期干预:对高风险个体实施早期干预,以预防疾病的发展。
定制治疗:开发针对特定遗传变异的治疗方法,提高治疗效果。
未来遗传学研究的主要趋势有哪些?
未来的遗传学研究将继续深化对遗传变异与复杂疾病之间关系的理解,并且越来越多地运用高通量测序技术、人工智能和机器学习算法来分析大规模生物数据。跨学科的融合将是一个显著趋势,生物信息学、计算生物学与实验生物学的结合将加速新发现的产生。同时,个性化医疗和精准医疗将进一步发展,基于遗传信息的疾病预测、预防和治疗策略将越来越普及。此外,CRISPR等基因编辑技术的应用将开辟遗传疾病治疗的新途径,同时也带来伦理和社会挑战
原文链接
https://doi.org/10.1016/j.cell.2024.01.023
Lappalainen T, Li YI, Ramachandran S, Gusev A. Genetic and molecular architecture of complex traits. Cell. 2024;187(5):1059-1075. doi:10.1016/j.cell.2024.01.023
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#遗传多样性# #全基因组关联研究#
74