CCR:GD2 CAR-T治疗髓母细胞瘤最新进展
2024-07-27 儿童肿瘤前沿 网络 发表于上海
展示了针对二唾液酸神经节苷脂(GD2)的嵌合抗原受体 (CAR T) 细胞疗法的研究,旨在发现一种潜在更有效并减少长期治疗副作用的治疗方法。
髓母细胞瘤(Medulloblastoma,MB)是儿童期最常见的恶性胚胎性脑肿瘤,约占所有小儿中枢神经系统恶性肿瘤的20%。世界卫生组织(WHO)将MB列为4级肿瘤,起源于位于后颅骨沟的神经元前体。目前标准治疗包括手术、放疗和化疗,但通常会导致认知、神经和内分泌系统的副作用。
近日,意大利耶酥儿童医院(IRCCS,Bambino Gesù)肿瘤血液学及细胞和基因治疗科系的 佛朗哥·洛卡特利团队 在 Clinic Cancer Research 发表题为 GD2-targeting CAR T-cell therapy for patients with GD2+ medulloblastoma 的文章,展示了针对二唾液酸神经节苷脂(GD2)的嵌合抗原受体 (CAR T) 细胞疗法的研究,旨在发现一种潜在更有效并减少长期治疗副作用的治疗方法。

GD2在神经母细胞瘤、黑色素瘤、视网膜母细胞瘤、许多尤文肉瘤、骨肉瘤、软组织肉瘤、小细胞肺癌和神经胶质瘤细胞中高表达,但在正常组织中的表达很有限。而且据报道,GD2 在小细胞肺癌和乳腺癌中,参与肿瘤发展,介导增加细胞增殖、生长、运动、迁移、粘附和侵袭。此外它通过与抑制性免疫受体Siglec-7相互作用,介导免疫抑制活性。该团队评估了CAR.GD2 T细胞在治疗复发/难治性儿童神经母细胞瘤中的安全性和有效性(临床实验编号NCT03373097)。
这篇论文收集52名患者和健康人的组织和血液样本,通过细胞荧光分析进行GD2表达的评估。与CAR-GD2.CD28.4-1BBz同框的第三代iC9自杀基因(作为安全开关)的逆转录病毒载体用于转导T细胞。外周血单核细胞 (PBMC) 是从健康捐赠者获得的血沉棕黄层中分离的,T细胞由OKT3和抗 CD28单克隆抗体激活,第三天由带有CAR-GD2的逆转录病毒载体转导。通过MB 患者肿瘤活检和外周血 (PB) 检测分析GD2的细胞表面表达。通过细胞共培养和流式细胞仪检测来评估CAR-GD2 T细胞的抗肿瘤效果。
实验结果
-
原代 MB 活检和 MB 细胞模型中的 GD2 表达
为研究MB是否可以作为CAR.GD2 T细胞的合适靶点,研究人员对临床接受治疗的 52 名 MB 患者进行活检,以评估肿瘤活标本上GD2的表达。尽管有异质性,但82.68% 的分析样本在流式细胞术分析中都表现出GD2 阳性,在CD45 阴性细胞中平均值为 50.46+/-35.90% GD2阳性细胞。另外在活检组织中GD2 表达的中值荧光强度 (MFI)高于外周血样。
-
CAR.GD2 T细胞在人源GD2+ MB 细胞系中显示有效的抗肿瘤活性
在体外长期共培养实验中,无靶T细胞(NT)和源自五个健康捐赠者CAR.GD2 T细胞与D283 Med、DAOY 或 MED 411-FHTC 细胞以1:1(E:T)的比例混合,与NT T细胞相比
CAR.GD2 T细胞能够明显地杀死D283 Med和MED 411- FHTC 细胞 (图1,A and C); 相比之下,当CAR.GD2 T 细胞与表征GD2 抗原的百分比和 MFI 较低的DAOY 细胞共培养时,只观察到了次优的抗肿瘤反应(图1,B)。细胞因子的产生量与CAR.GD2 T 细胞表现出的抗 MB 活性有密切的关系 (图1,D,E,F)
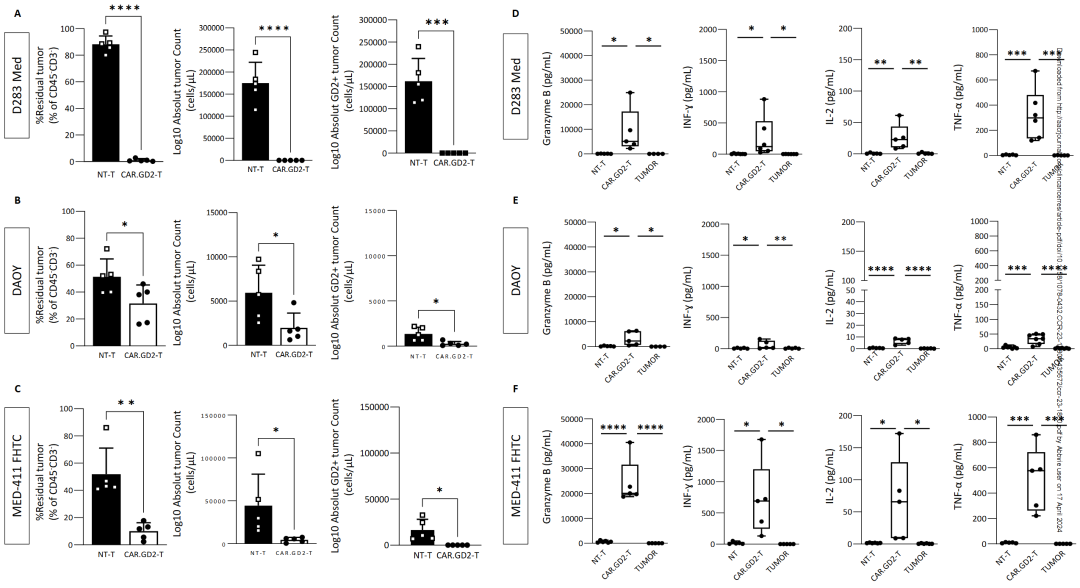
图1- CAR.GD2 T 细胞在人源 GD2+ MB 细胞系和 MB-PDX 细胞的体外抗肿瘤活性
-
EZH2 抑制剂在GD2低表达MB 细胞系体外实验中能增加 GD2的表达
鉴于MB 细胞系上 GD2 表达的异质性, 研究人员研究了他泽美司他对GD2低表达的MB 肿瘤是否也能产生相同的效果。在DAOY (SHH) 和 MED-411 FHTC 细胞系培养中加入他泽美司他(1 或 10 mmol/L)或同等体积的DMSO 为阴性控制,7 天后,他泽美司他明显地增加了GD2 在这两株MB 细胞系中的表达 (图2,A-C)。在5 天共培养实验中,CAR.GD2 T 细胞使DAOY细胞减少表明,高、低浓度的他泽美司他在DAOY细胞系中能诱导GD2 靶抗原上调(图2,C)。
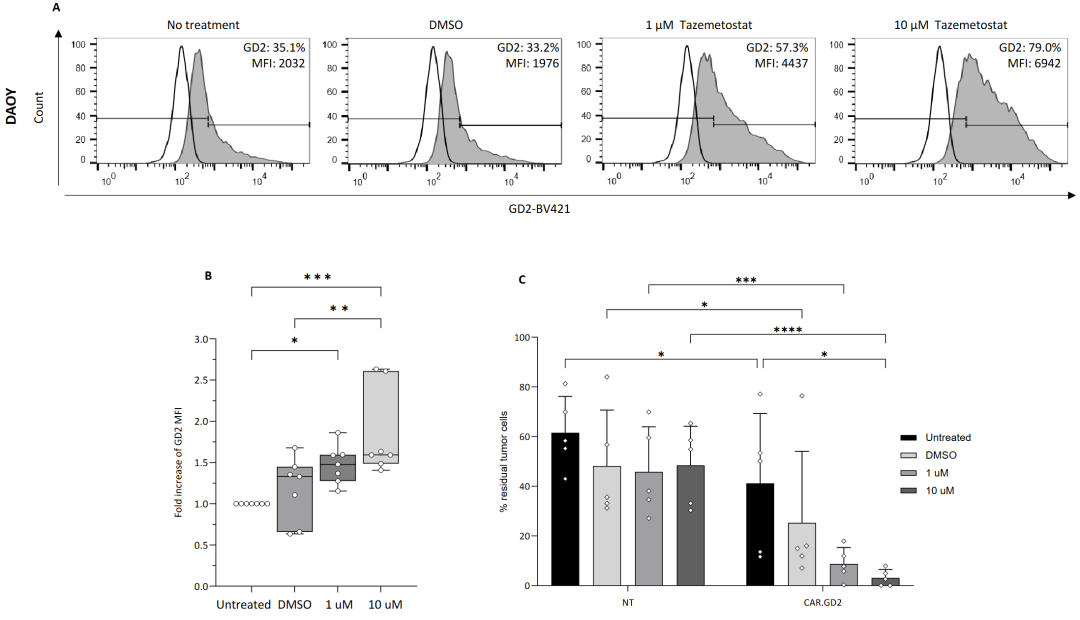
图2-用他泽美司他抑制 EZH2 可上调 DAOY(SHH 亚组)MB 细胞中的 GD2 表达
-
CAR.GD2 T细胞在异种MB小鼠中显示抗肿瘤活性
在MB NSG 小鼠模型中,使用原位植入 D283 Med细胞,肿瘤移植三天后,小鼠随机分为NT T 细胞组或 CAR.GD2 T 细胞组,静脉注射治疗的CAR.GD2 T 细胞来自两个健康捐赠者(图3,A和B)。正如预期的那样, NT T细胞组的小鼠,在不到一个月的时间内,肿瘤生物发光迅速增强到三个数量级,而接受 CAR 治疗的小鼠组,在第 30 天后肿瘤明显地得到控制(图3,B-D),无病生存率明显高于NT T细胞小鼠组(图 3,E)。CAR.GD2 T细胞治疗的小鼠出现人源异种移植反应迹象,八分之三的小鼠在缓解期死亡(图 3F),可能是由于移植物抗宿主病(GVHD),在加大T细胞注入量的小鼠身上副作用更明显(图3,G和H),更重要的是, 45 天后循环 CAR+ T 细胞的百分比仍然可检测到,并且随着时间的推移而有所增加(图 3H)。
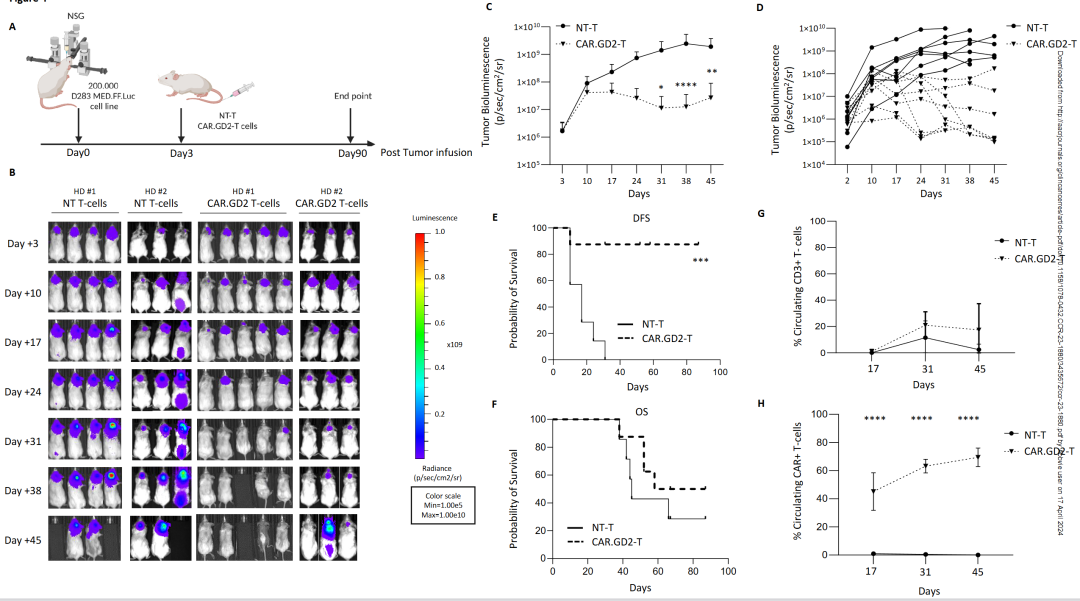
图3- CAR.GD2 T 细胞的抗肿瘤活性在人源D283 Med-GFP-FF-Luc 细胞系原位小鼠模型中的评估
-
他泽美司他预处理可增强抗肿瘤作用
将 DAOY MB 细胞系植入 30 只 NSG 小鼠颅内,其中一半通过口服强饲法喂入他泽美司他,研究人员评估了他泽美司他有穿过血脑屏障(BBB)的能力,并使肿瘤细胞对 CAR GD2 T细胞敏感。小鼠使用他泽美司他并接受 CAR.GD2 T 细胞显示出明显的早期抗肿瘤反应(T 细胞输注后第 6 天),然而,在 CAR.GD2 T 细胞治疗第14天,研究人员没有观察到两组之间的肿瘤控制的差别。这一发现与体外实验结果高度一致,表明GD2 MFI 水平的降低和停止使用他泽美司他有关。
-
静脉注射CAR.GD2 T细胞浸润到MB组织可增加MB PDX模型中小鼠的总生存率
为了进一步研究 CAR.GD2 T 细胞在体内的功能,NGS小鼠被植入 Med-411FH mCherry / Luciferase 细胞,肿瘤形成后第 15天,小鼠接受静脉注射输注NT T细胞或 CAR.GD2 T 细胞。在NTT小鼠组中,40天后,肿瘤的生物发光迅速增加到3个数量级,而接受CAR GD2 T 细胞的小鼠,肿瘤生长时间有较长的控制,并且生物发光信号有显着降低,一句话,总生存率增加。此外,与对照小鼠相比,CAR.GD2 T 细胞在外周血循环的T 细胞中 (CD45+/CD3+) 数量有显着的增加。
-
AP1903 能激活 iC9 自杀基因,在MB-PDX 小鼠模型中可消除CAR.GD2 T 细胞
为了消除CAR GD2 T 细胞的毒性,研究人员评估了可否通过全身给药AP1903来激活 iC9 自杀基因达到快速消除血液循环中和渗透到大脑/MB 中的 CAR T 细胞。免疫组织化学分析表明CAR.GD2 T 细胞能穿过血脑屏障(BBB)渗透到肿瘤中,而且通过AP1903 治疗的小鼠,渗透到大脑/MB中的T细胞消失了,证明AP1903有穿过血脑屏障并消除肿瘤浸润 CAR.GD2 T 细胞的能力,如图4所示。A-建模设计图,Med-411 FH mCherry/Luc PDX 细胞被立体定向植入 13 只 NSG 小鼠的小脑中。肿瘤移植30 天后,12 只小鼠通过静脉注输入T 细胞(其中 6 只小鼠为 CAR.GD2 T 细胞,6 只小鼠为 NT T 细胞)。第 10 天,给小鼠AP1903药,六分之三接受 NT T 细胞治疗的小鼠和六分之三接受 CAR.GD2 T 细胞治疗的小鼠接受了连续三剂 AP1903(100 毫克/天/小鼠)。给药前一天和实验结束时第 14 天,对实验小鼠的外周血进行人源 T 细胞的流式细胞术分析。B-AP1903 有效诱导循环 CAR.GD2 T 细胞的明显减少。C- 对MB 的小鼠进行人源 CD3+ T 细胞(左)或 CAR+ T (右)流式细胞术分析,未经处理的 GD2 T 细胞(上)和经 AP1903 处理的细胞(下)。
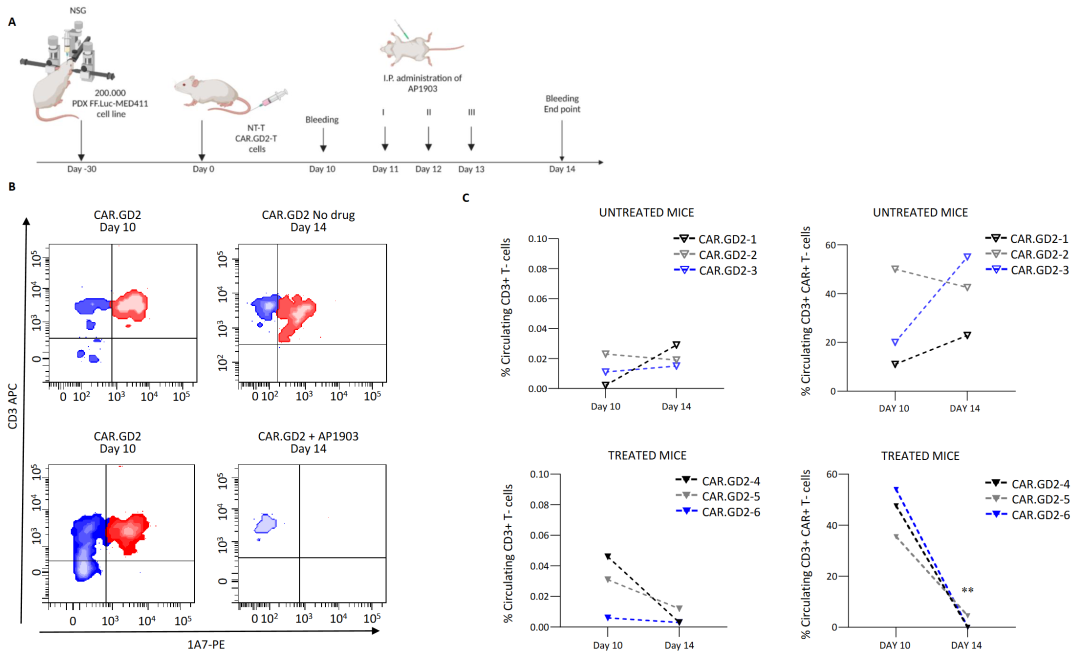
图4-AP1903 激活 iC9,并导致 MB 异种移植小鼠模型外周血中的 CAR.GD2 T 细胞迅速减少
这篇论文首次报告了GD2在大量MB儿科患者中表达的评估,发现尽管异质性大,但GD2在诊断时在大多数 MB 病例中过度表达。更重要的是,SHH 和 G3/G4 亚组显示出最高的 GD2 表达,因此CAR.GD2T 细胞疗法对这类最具攻击性的MB亚型患者是一种合适的免疫疗法。
最近的 I/II 期临床试验显示了CAR.GD2 T 细胞在神经母细胞瘤患者中治疗的安全性和疗效。鉴于这些前提,GD2是可被选择作为肿瘤相关的MB 患者的抗原,被 CAR.GD2 T 细胞靶向。在对 GD2+ MB 的临床前实验中,该论文报告了CAR.GD2 T 细胞介导通过长期共培养实验证明,对 GD2+ MB 细胞系和 MB PDX 模型具有显着的杀伤活性。实验还证明了肿瘤识别和消除与抗原表达水平密切相关。癌细胞上靶抗原的低表达是众所周知的CAR T细胞疗法耐药的潜在机制。最近,有报道除骨肉瘤细胞外,尤文肉瘤、神经母细胞瘤和肺癌,使用他泽美司他EZH2 抑制剂,可选择性地和可逆性地诱导 GD2 表面表达而不改变细胞其他性质。研究人员还证明了他泽美司他可以穿过血脑屏障并上调MB细胞中GD2的表达,使它们对 CAR.GD2 T 细胞的杀伤力敏感。此外,自杀基因 iC9 能够增加CAR.GD2 T 细胞疗法的安全性,通过使用AP1903激活iC9自杀基因诱导快速消除血液循环和已经穿过血脑屏障的CAR T 细胞。希望这些结果在 GD2+ MB 患者中进行 的I/II 期临床试验(NCT05298995)得到验证。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















#髓母细胞瘤# #CAR-T治疗#
44