Cell:新冠疫苗任重道远:多种COVID-19变异株通过疫苗诱导的体液免疫逃避中和
2021-03-25 MedSci原创 MedSci原创
重要的是开发能够防止各种SARS-CoV-2变种传播的干预措施,包括针对这些变种的疫苗增强剂,或者能够诱导或传递广泛中和抗体的技术。
疫苗接种能激发免疫反应,有效中和SARS-CoV-2病毒。然而,正在进行的监测显示,在中和抗体的主要目标spike中出现了含有突变的变体。为了了解这些变异的影响,Alejandro B. Balazs等评估了部分疫苗,文章发表在Cell杂志。

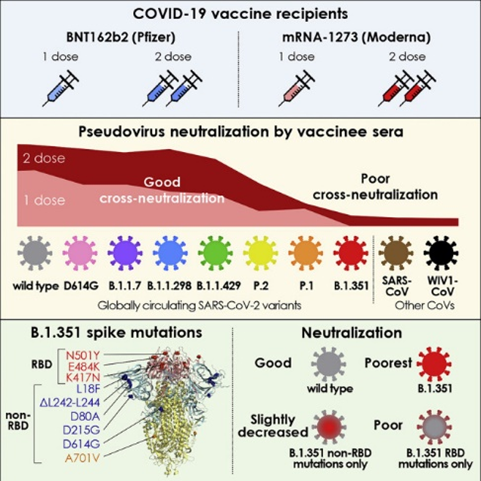
该研究评估了99名接受一剂或两剂BNT162b2或mRNA-1273疫苗的人对代表10种全球流行的SARS-CoV-2伪病毒的中和效力。在10个含有受体结合区突变的伪病毒中,有5个病毒,包括K417N/T、E484K和N501Y,高度抵抗中和。B.1.351变异体的交叉中和作用与SARS-CoV和BAT衍生的WIV1-CoV相当,表明相对较少的突变可以介导有效的疫苗逃逸。
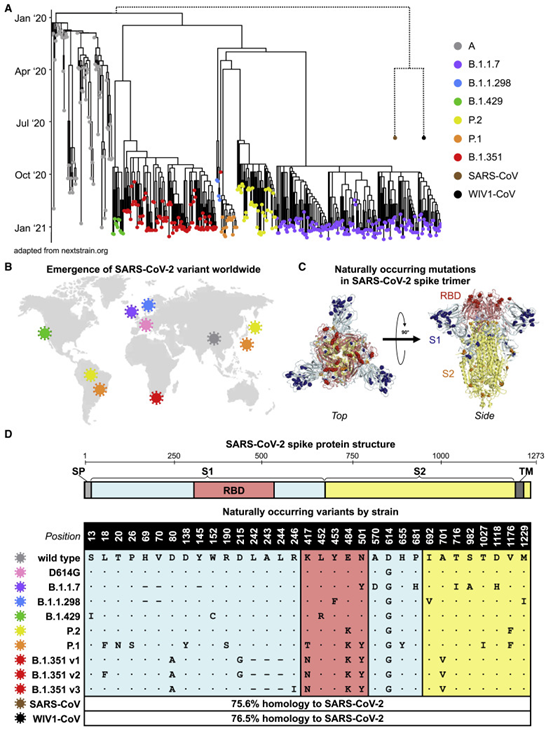
令人担忧的SARS-CoV-2变种在世界各地的出现和传播。
(A)SARS-CoV-2变异株(改编自nextstrain.org)的系统发育树显示了采样日期,重点放在以下谱系上:A(灰色)、B.1.1.7(紫色)、B.1.1.298(蓝色)、B.1.429(绿色)、P.2(黄色)、P.1(橙色)和B.1.351(红色),其中A(灰色),B.1.1.7(紫色),B.1.1.298(蓝色),B.1.429(绿色),P.2(黄色),P.1(橙色)和B.1.351(红色)。SARS-CoV(棕色)和蝙蝠衍生的WIV1-CoV(黑色)的虚线不是比例,但表明与SARS-CoV-2有较远的系统发育关系。
(B)描绘首次描述这些谱系变异的地点的世界地图:中国武汉A谱系的原始野生型病毒(灰色);欧洲成为主要流行毒株的D614G变异株(粉红色);英国的B.1.1.7谱系(紫色);丹麦的B.1.1.298(蓝色);美国加利福尼亚州的B.1.429(绿色);巴西和日本的P.2(黄色);巴西和日本的P.1(橙色);以及B.1.351(红色)。
(C)聚变前稳定的SARS-CoV-2刺突三聚体(PDB:7JJI)的晶体结构以左图(左图)和右图(右图)显示。自然发生突变的位置用彩色球体突出显示的残基原子表示。刺突区域和相关突变的颜色如下:受体结合域(RBD)为红色,S1(不包括RBD)为蓝色,S2为黄色。
(D)展示了SARS-CoV-2刺突蛋白结构示意图和本研究中使用的变异株的突变情况。每个变异体中存在的突变代表该谱系的共识序列,并代表实际的流通毒株:A(野生型)、B.1.1.7、B.1.1.298、B.1.1.429、P.2和P.1谱系。在B.1.351谱系的情况下,对GISAID中保存最丰富的三个变异(v1、v2和v3)进行了评估。SARS-CoV和WIV1-CoV的同源性为百分率。使用以下缩写:SP,信号肽;TM,跨膜域;RBD,受体结合域。在突变图谱中,点(∙)表示该位置的氨基酸与野生型相同,破折号(-)表示缺失。

该研究中测试的SARS-CoV-2变种
下列SARS-CoV-2变异株的刺突蛋白序列突变示意图如下:野生型(灰色)、D614G(粉色)、B.1.1.7(紫色)、B.1.1.298(蓝色)、B.1.1.429(绿色)、P.2(黄色)、P.1(橙色)、B.1.351(红色;v1、v2和v3)、SARS-CoV(棕色)和WIV1-CoV(黑色)。
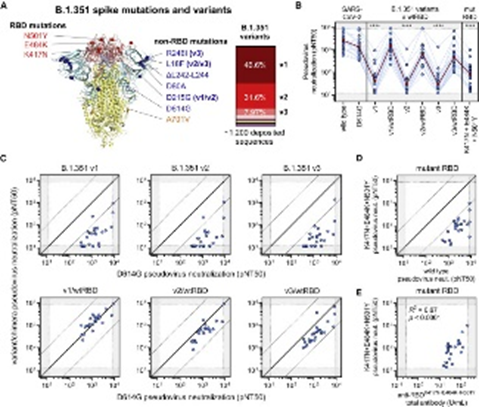
SARS-CoV-2 B.1.351株有限交叉中和主要是由于RBD突变。
(A)融合前稳定的SARS-CoV-2刺突三聚体(PDB:7JJI)含有B.1.351突变体的RBD和非RBD突变位点,其晶体结构以彩色球状突出的残基原子表示。刺突和相关突变的颜色如下:RBD为红色,S1(不包括RBD)为蓝色,S2为黄色。在仅存在于某些变体中的突变的情况下,指示它们出现的变体(v1、v2和/或v3);所有其他突变都存在于三个被测试的B.1.351变体中。B.1.351v1、v2和v3变体的相对频率(由存放在GISAID中的序列确定)如右图所示。
(B)中和B.1.351v1、v2和v3变异体与缺乏RBD突变的嵌合体变异体(分别表示为v1/wtRBD、v2/wtRBD和v3/wtRBD)在接种第二剂BNT162b2 7天后的≥中进行比较。血清还检测了仅含有B.1.351(K417N、E484K和N501Y)RBD突变的伪病毒。暗红线表示每个假病毒的相对中和的几何平均值。灰色区域表示检测的上限和下限。
(C)D614G和B.1.351嵌合病毒的假病毒中和滴度之间存在相关性。同一性的实斜线表示相同的中和,而虚线的黑线表示假病毒中和(PNT50)相差10倍。
(D)K417N+E484K+N501Y变异假病毒的假病毒中和(PNT50)与野生型假病毒相关。暗红线表示每个假病毒的相对中和的几何平均值。灰色区域表示检测的上限和下限。
(E)用定量ELISA法检测与携带B.1.351突变RBD的RBD结合的总抗体(抗RBDK417N+E484K+N501Y总抗体),并与K417N+E484K+N501Y变异假病毒的假病毒中和(PNT50)相关。
传统上,在感染和疫苗接种的背景下产生的多克隆免疫反应被认为是针对多个抗原表位的。鉴于这一假设,人们预计抗原序列中的少量变异对免疫系统的识别只会产生轻微的影响。但该研究发现,虽然许多毒株,如B.1.1.7、B.1.1.298或B.1.429,尽管存在个别RBD突变,但仍能被有效中和,而其他循环中的SARS-CoV-2变异株可逃脱疫苗诱导的体液免疫。在RBD区域内包含E484K突变的变异体能够显著降低完全接种疫苗的个体的中和效力。同样,具有三个RBD突变的P.1毒株更有效地逃脱了中和,这可能解释了最近报道的使用这种变异株再次感染的病例。该研究还发现B.1.351变异体表现出显著的中和抗性,主要是由于RBD的三个突变,但也有来自非RBD突变的可测量的贡献。这种影响的幅度如此之大,以至于B.1.351株病毒能够像远亲冠状病毒一样有效地逃脱中和疫苗反应。
总而言之,该研究突显了所有疫苗面临的挑战,这些疫苗的设计是在大流行早期完成的,并基于来自中国武汉的首例报告病毒的序列。鉴于正在进行的大流行的全球规模和规模,包括再感染病例报告,很明显,病毒的进化将继续下去。目前的疫苗仍有可能通过降低新冠肺炎的严重程度,对交叉中和能力较差的变异株(如P.1和B.1.351)提供临床益处,但这一点尚未确定。最终,重要的是开发能够防止各种SARS-CoV-2变种传播的干预措施,包括针对这些变种的疫苗增强剂,或者能够诱导或传递广泛中和抗体的技术。虽然中和耐药性的临床影响仍不确定,但这些结果突显了变异株逃避中和体液免疫的可能性,并强调需要制定广泛的保护性干预措施,以应对不断演变的大流行。
原文出处:
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#Cell#
70
#CEL#
91
#变异#
66
新冠肺炎,疫情何时才能消失
75