ASH 2022:BMS的CD3/BCMA双抗Alnuctamab治疗RRMM初步数据公布
2022-12-13 MedSci原创 MedSci原创 发表于上海
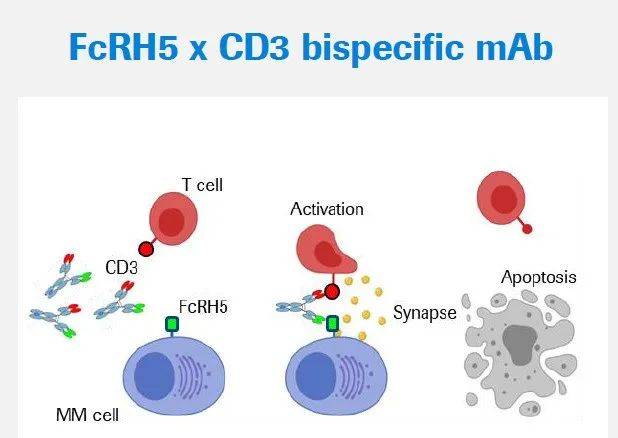
BMS公布其靶向BCMA x CD3双特异性抗体alnuctamab治疗RRMM患者的最新临床1期数据。
BMS公布其靶向BCMA x CD3双特异性抗体alnuctamab治疗RRMM患者的最新临床1期数据。 Alnuctamab的皮下注射剂(SC)与静脉注射剂(IV)相较,其安全性有显著改善,所造成的细胞因子综合征(CRS)多属于低级别,使得在剂量递增试验中可使用较高剂量的抗体。静脉与皮下注射的alnuctamab皆展现出色疗效 ,接受皮下注射alnuctamab患者的ORR为53%(36/68)。
截至2022年5月31日数据截止,70例患者接受静脉ALNUC治疗,39%(27/70)达到客观缓解,mPFS为13.3周(95% CI, 8.1-23.9)。获得静脉ALNUC缓解的患者mDoR为146.1周(95% CI, 40.6-NE)。
47例患者接受SC ALNUC剂量递增(10mg: n=6;15mg: n=4;30mg:n=6;60mg:n=3)和剂量扩展(10mg:n=9;30mg:n=9)治疗。在2022年5月31日数据截止时,中位随访时间为2.6个月(范围:0-11.4),68%(n=32)的患者继续接受SC ALNUC治疗。
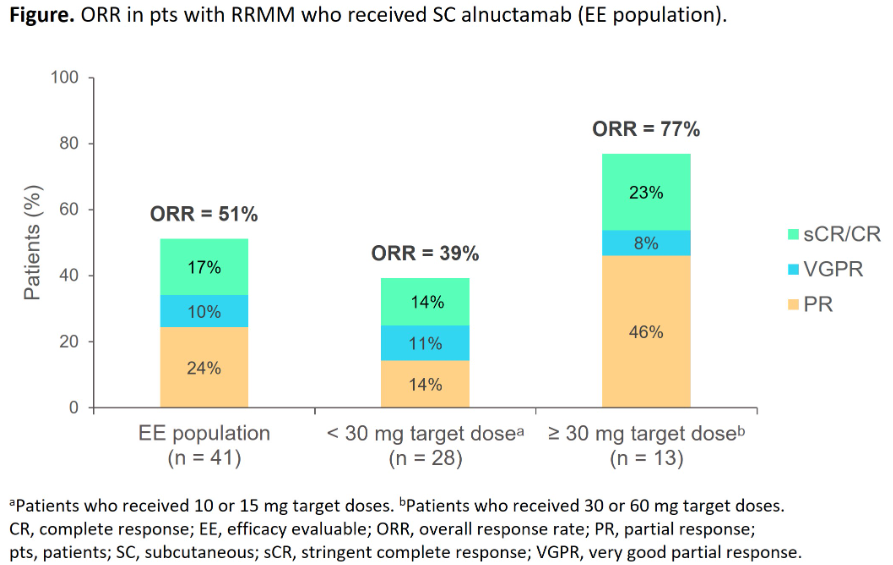
41名患者疗效可评估,总人群ORR为51%(21/41),剂量≥30mg患者ORR为77%(10/13)。在获得缓解的 21 名患者中,14 名患者具有可评估的 MRD 样本,并且所有 (100%) 在 C2D1 或 C4D1 时均为 MRD 阴性(10-5 灵敏度)。mDoR为4.3周(范围4.1-17.4),所有21例缓解(100%)均在持续中。
任何级别或者3-4级TEAE发生率分别为89%和62%;最常见的是CRS(53%/0%)、中性粒细胞减少症(34%/30%)和贫血(34%/17%)。所有CRS事件限制在1级(21例;45%)或2级(4例;9%),20 名患者接受了 ≥ 1 种 CRS 伴随药物治疗,包括托珠单抗 (n = 12) 和/或皮质类固醇 (n = 8)。CRS 发作的中位时间为 3 天(范围,1-20 天); 中位持续时间为 2 天(范围,1-11)。 在 16 名患有 3-4 级中性粒细胞减少症的患者中,中位缓解时间(≤ 2 级)为 6 天(范围,1-36)。 1例1级免疫效应细胞相关神经毒性事件。无因不良事件停止治疗的患者,没有发生与治疗相关的死亡事件。
初步群体药代动力学分析估计 SC ALNUC 的生物利用度约为 70%; 到 C1 结束时,30 mg SC 达到与 10 mg IV Cmax 观察到的相似浓度; 基线体重不是暴露的重要协变量。 使用 SC 和 IV ALNUC 观察到 TCE 的标志性药效学效应(外周血免疫细胞再分布、瞬时细胞因子释放和与抗肿瘤活性相关的 T 细胞因子的诱导)。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言