J Hepatology:中科院胡荣贵团队揭示为什么大多数人感染乙肝病毒后会自行痊愈
2021-04-30 “生物世界”公众号 “生物世界”公众号
乙型肝炎病毒感染是一个重要的全球性健康问题,是导致肝炎的主要原因之一。目前世界上乙型肝炎病毒的慢性感染病例数为3.5到4亿,75%的被感染者是亚洲人。中国HBV感染相关的肝病和肝癌极为常见,每年造成4
乙型肝炎病毒感染是一个重要的全球性健康问题,是导致肝炎的主要原因之一。目前世界上乙型肝炎病毒的慢性感染病例数为3.5到4亿,75%的被感染者是亚洲人。中国HBV感染相关的肝病和肝癌极为常见,每年造成40万左右肝癌病人的死亡。
与新冠病毒不同,儿童时期垂直感染的病例是HBV感染人类的主要途径,感染了乙型肝炎病毒的患者中有约25%会在成年后发展成肝纤维化或肝癌。一般来说大多数成年时期(约65%以上)感染HBV后基本上没有明显症状,最后机体会清除掉体内的HBV,提示在成年人中的HBV感染是自限性的,而其机制未知。
4月5日,中国科学院分子细胞科学卓越创新中心胡荣贵研究员、复旦大学基础医学院邓强教授、复旦大学华山医院张继明教授、国家蛋白质科学凤凰中心徐平教授为共同通讯作者,在肝病学领域顶级期刊 Journal of Hepatology 发表了题为:Translatomic profiling reveals novel self-restricting virus-host interactions during HBV infection的研究论文。
该研究发现乙型肝炎病毒(Hepatitis B virus, HBV)的P基因和X基因分别各自编码了一个同源异构体HpZ/P'和HBxZ,它们可以抑制HBV复制。该研究还发现了一个定位在HBV增强子I区域的翻译调控元件。
该研究使用转录组测序技术(RNA-sequencing)结合核糖体图谱技术(ribosome profiling),结合定量蛋白组学系统性地分析HBV和宿主的相互作用。通过研究一个最近开发出来的1.0倍HBV重组cccDNA系统,研究人员发现了一个定位在HBV基因组增强子I区域的翻译调控元件EnhI-SL(stem loop within enhancer I),细胞研究表明突变破坏其茎环结构可以增强报告基因或HBV聚合酶表达,但是对其转录没有明显影响。
此外,核糖体图谱分析结合定量质谱以及突变研究发现并证实,HBV的P基因和X基因会分别编码一个截短体,命名为HpZ/P'和HBxZ,其中HpZ/P'的产生依赖于HBV前基因组RNA的两个特定位点的剪接,并且这种剪接方式是HBV前基因组RNA所有剪接方式里丰度最高且最保守的。
HBxZ的翻译依赖于核糖体识别HBx转录本内部保守的起始密码子。分别过表达这两个基因可以显着抑制HBV的三个主要抗原,HBc,HBs以及HBe的表达,而过表达HCV的聚合酶或一个不相关的宿主基因MAP2K2则没有抑制作用。同时,southern blot分析和动物实验显示HpZ/P’可以抑制HBV基因组的复制和转录。
使用二代测序和三代测序对处于免疫耐受期或免疫激活期的慢性乙肝患者的血清进行HBV准种分析发现,特异性删除HpZ/P'但不影响HBV前基因组RNA剪接的突变体A2446G,以及破坏EnhI-SL元件的突变体G1164A在免疫耐受期的病人的准种里占有的比例明显高于免疫激活期,提示这两个突变可能经历了宿主免疫系统的负向筛选。
机制上,研究人员发现宿主蛋白SUPV3L1可以促进HBV基因表达,提示它可能是HBV挟持的一个宿主因子,HpZ/P'可以与宿主的SUPV3L1蛋白相互作用并抑制SUPV3L1对HBV基因表达的促进作用。此外,研究发现HpZ/P'可以与HBx相互作用并影响HBV 重组cccDNA的表观遗传修饰。
最后,本研究发现SRSF2,一种宿主RNA剪接体的组成成分,在HBV复制期间被下调;过表达SRSF2可以促进病毒前基因组RNA剪接依赖的HpZ/P'产生。
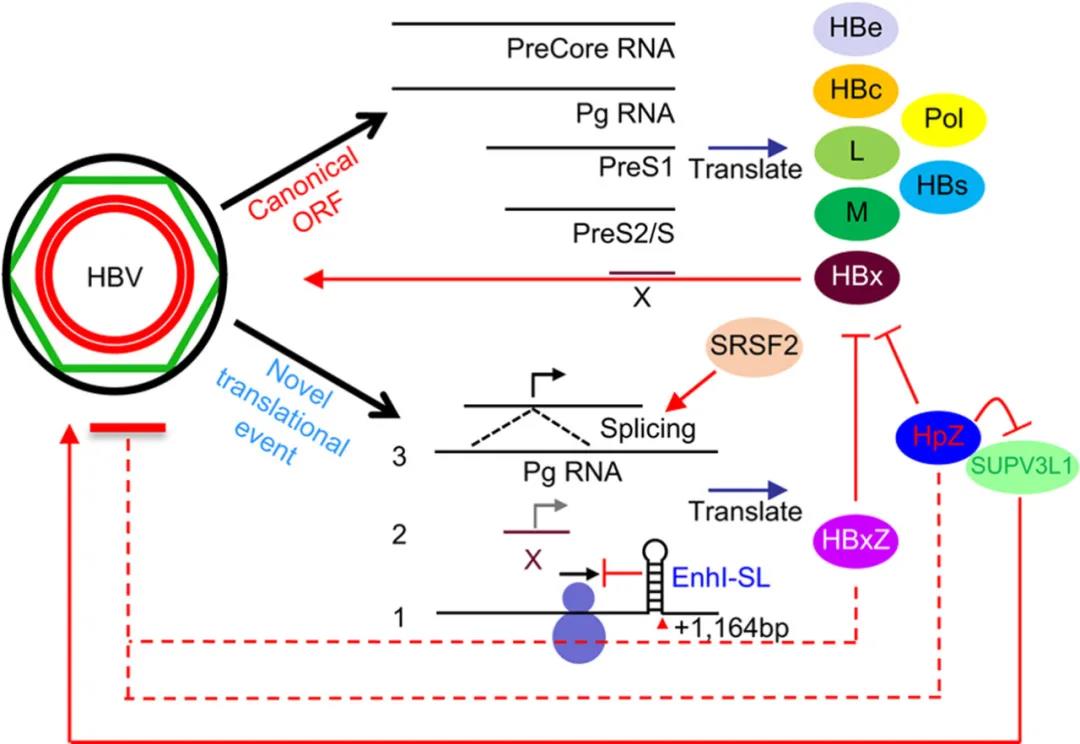
总之,本研究从多组学整合分析出发,揭示了乙肝病毒与宿主的相互作用中的多种自限性机制,针对这些机制的发现一方面有助于理解HBV感染相关的生物学过程,也为发展全新的靶向干预策略奠定了基础。其中,SRSF2-HpZ/P'轴似乎构成乙肝病毒生活周期中的另一种负反馈调节环路。因此,靶向宿主剪接体可能代表着干预乙肝病毒-宿主相互作用的新策略。
中科院分子细胞卓越中心胡荣贵研究员、复旦大学基础医学院邓强教授、复旦大学华山医院张继明教授、以及国家蛋白质科学凤凰中心、中国医学科学院徐平教授为共同通讯作者,分子细胞卓越中心博士后袁施琳,博士生廖光红和副研究员张梦欢以及复旦大学博士后朱园飞为共同第一作者。慕尼黑亥姆霍兹研究中心Axel Walch教授和孙娜为合作者。特别感谢中科院分子植物科学卓越创新中心韩斌院士、黄学辉研究员和冯旗研究员、国家蛋白质中心(上海)彭超老师和中科院药物所周虎研究员对本研究提供的大力帮助。该工作也得到分子生物学技术平台和细胞分析技术平台的大力支持,并得到来自中科院、基金委、科技部以及上海市科委等部门的经费支持。
原始出处:
Shilin Yuan, et al. Translatomic profiling reveals novel self-restricting virus-host interactions during HBV infection. Journal of Hepatology, February 20, 2021DOI:https://doi.org/10.1016/j.jhep.2021.02.009.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#中科院#
62
#J Hepatology#
0
#EPA#
65