降脂治疗的生物技术与靶向药物新进展,读这一篇就够了!
2022-08-04 中国医学论坛报今日循环 网络
大量靶向新途径和致病性脂蛋白的治疗措施正在蓬勃发展。他汀类药物目前仍然是临床上首选的基础降脂药物。
友谊“心”视野-前沿进展
本栏目由首都医科大学附属北京友谊医院心血管中心李虹伟教授团队与中国医学论坛报合作推出。
2022年,友谊“心”视野全新改版,前沿进展专栏上线!专栏进一步聚焦心血管领域最新研究、文献进展等资讯,为大家分享更多角度的前沿内容。每月一期,欢迎持续关注。
本期话题:降脂治疗研究新进展
本期作者:首都医科大学附属北京友谊医院 崔贺贺 沈爱东
血脂代谢异常是动脉粥样硬化发生发展的基本机制,也是动脉粥样硬化性心血管疾病(ASCVD)重要的可改变危险因素。
目前针对血脂代谢异常的治疗手段众多,其中,针对低密度脂蛋白胆固醇(LDL-C)这一重要靶点的降脂治疗药物成为防治ASCVD的基石,包括:
临床上应用广泛的抑制3-羟基-3-甲基戊二酰辅酶A(HMG-CoA)还原酶的他汀类药物;
作用于小肠黏膜上皮刷状缘及肝脏胆固醇转运蛋白NPC1L1的依折麦布和海博麦布等胆固醇吸收抑制剂;
以依洛尤单克隆抗体和阿利西尤单克隆抗体为代表的前蛋白转化酶枯草溶菌素9 (PCSK9)抑制剂。
随着人类遗传学研究的进步以及生物制剂和RNA靶向药物技术的发展,血脂代谢异常的治疗手段也有了新的进展。
一些新型降脂治疗靶点的发现,如脂蛋白C-Ⅲ、血管生成素样蛋白3和4(ANGPTL 3和4)、脂蛋白Ⅴ和三磷酸腺苷柠檬酸裂合酶(ACL),为LDL和其他血脂目标风险的管理提供了新途径;此外,除了LDL-C,针对富含甘油三酯(TG)脂蛋白和脂蛋白(a)[Lp(a)]的新治疗手段已经问世并进入临床阶段。
近期发表在《欧洲心脏杂志》(EHJ)上的一篇综述很好地概括了调脂治疗的趋势:从化学制剂到抗体、核糖核酸(RNA)和基因治疗;从每日给药一次到间隔半年给药一次……
创新性靶向策略的开发提高了其中一些干预措施的治疗效率,极大改善了耐受性,并显著减少了不良反应。

本期友谊“心”视野即基于不同调脂手段的综述及评论,对新型降脂治疗尤其是靶向治疗的要点进行了整理,以飨读者。
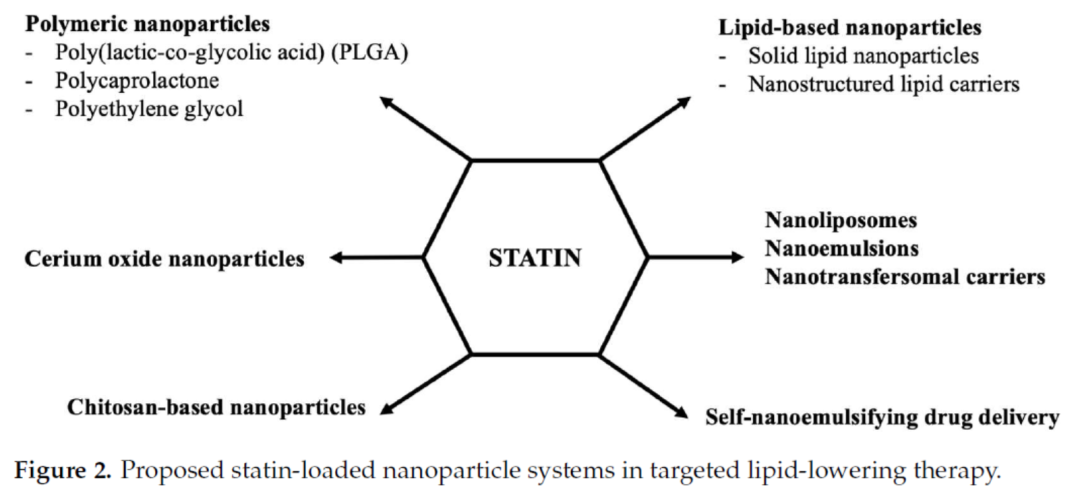
1包载他汀类药物或依折麦布的纳米递送系统
纳米载药技术能够靶向递送药物,提高传统药物的生物利用度。许多他汀类药物水溶性差、代谢快、生物利用度低,并具有肝损伤等多种临床不良反应,而纳米载药技术可有效提高其治疗效果,减少不良反应尤其是肝损伤。,
主要的递送系统包括聚合物纳米粒、脂质纳米粒、壳聚糖纳米粒、纳米脂质体、纳米乳液、纳米转移体载体、自纳米乳化系统和铈氧化物纳米颗粒。
初步证实
这些纳米药物均可提高他汀类药物的生物利用度,减少给药剂量,并大大降低药物不良反应。
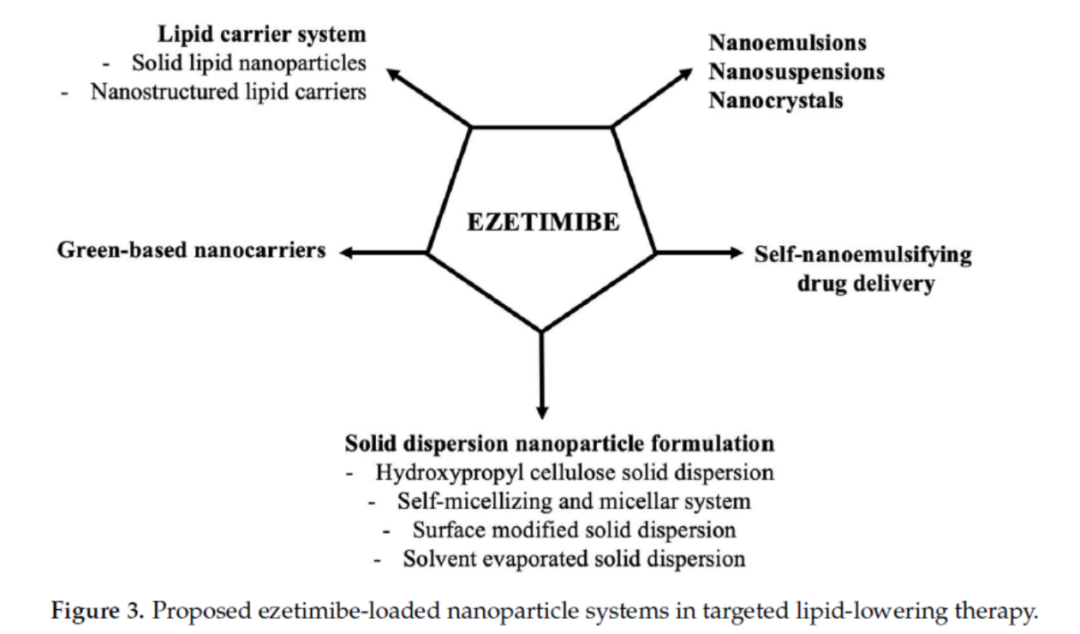
同样,载有依折麦布的纳米递送系统可以改善水溶性差、吸收率低、排出率高而导致的生物利用度低这一问题。
2靶向抑制PCSK9的siRNA药物
除单克隆抗体外,小分子化合物、PCSK9疫苗以及靶向PCSK9合成和表达的小干扰RNA(siRNA)均能实现对PCSK9的抑制。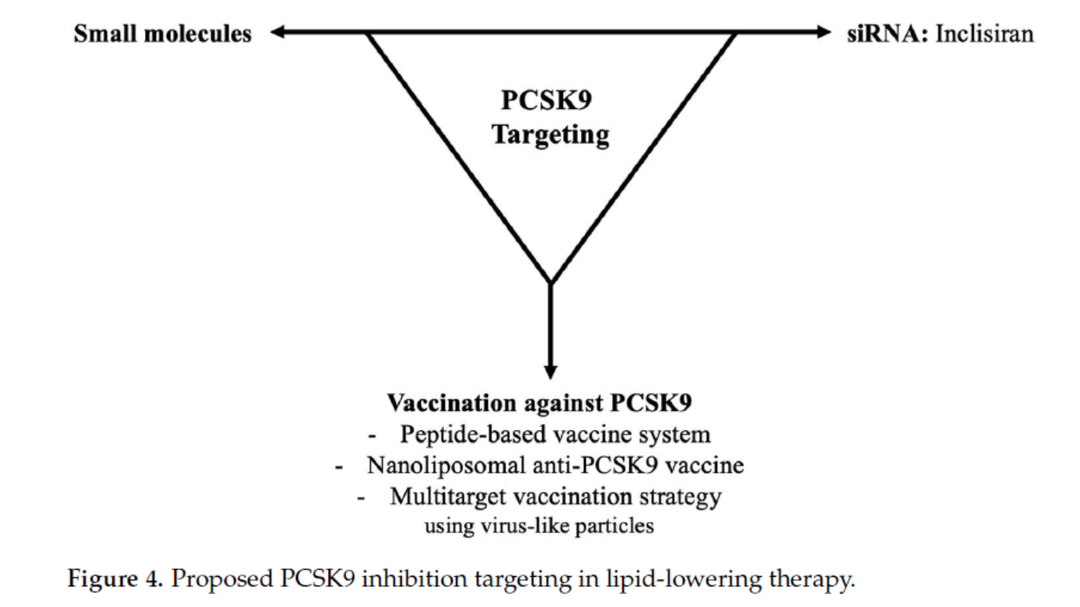
目前,前两种全新的方法仍处于临床前研究阶段,而 siRNA 已经进入Ⅲ期临床试验阶段。
siRNA药物的代表有inclisiran及olpasiran。
Inclisiran是一种化学合成的双链siRNA,通过N-乙酰半乳糖胺(GalNAc)优先靶向递送到肝细胞,能够直接拮抗PCSK9信使核糖核酸(mRNA),抑制PCSK9蛋白合成,促进肝细胞表面LDL-C的再循环和表达,从而加速LDL-C的摄取并降低血液循环中的LDL-C水平。
Inclisiran 可以通过预充针管皮下注射给药,每个针管预充的 1.5 ml 溶液里 包 含 284 mg inclisiran。Inclisiran 的推荐治疗剂量为284 mg。前两次的治疗时间分别为第1天和第90天,之后每半年一次。
Inclisiran结构中的核酸骨架被修饰过,能够限制其分解;另外,这种siRNA的一个分子可以诱导多个mRNA拷贝连续降解,所以,皮下注射一次即可产生3~6个月的持久效果。
在 Ⅱ 期 临 床 研 究(ORION-1 研究)中,接受最大剂量他汀类药物的受试者加用inclisiran后, 6个月内 LDL-C水平再降低53%。
临床随访观察期,inclisiran组仅有5%的患者出现了轻微的注射部位反应,除此以外,其不良事件的发生率与安慰剂无明显差异。这一结果与另外两项Ⅲ期临床试验(ORION-10研究和ORION-11研究)的结果相符。
与安慰剂相比,该治疗对肝脏或肾脏功能、肌酸激酶、高敏C反应蛋白(hs-CRP)或血小板计数均没有影响。
由于能稳定且持久地降低LDL-C,inclisiran有助于提高患者的依从性,帮助更多患者血脂达标并长期维持。2020年10月9日,欧盟批准inclisiran的临床适应证为原发性高胆固醇血症及混合性血脂异常。
3新作用机制药物:贝派地酸
贝派地酸是一种具有新型作用机制的小分子前体药,口服后经肝脏中的长链酰基辅酶a合成酶1活化才能发挥作用,其通过抑制细胞质中的ACL阻断了胆固醇合成途径中柠檬酸盐向乙酰辅酶A的转化,从而调节了LDL-C的水平。
贝派地酸特定作用于肝脏而不抑制肌肉中胆固醇的合成,因此避免了他汀类药物所引发的肌肉疼痛的副作用。此外,贝派地酸还能激活单磷酸腺苷激活的蛋白激酶(AMPK),调节影响炎症信号和脂质代谢底物的磷酸化。
临床研究表明,贝派地酸单药治疗或与其他降脂治疗联合可显著降低血浆中LDL-C、非HDL-C、Apo B和hs-CRP水平。一项对3623例高胆固醇血症患者的汇总分析显示,在他汀治疗的基础上,相较于安慰剂,贝派地酸可使LDL-C降低17%~25%。
贝派地酸与他汀类药物和依折麦布的降脂机制不同,所以其既可以作为单一疗法,也可以与上述药物联合应用。
与他汀类药物对血糖的影响不同,使用贝派地酸时,新发糖尿病和高血糖的发生率较低。这可能与贝派地酸激活AMPK导致糖异生和脂肪酸合成减少有关,而这是他汀类药物所不具备的效果。
相较于安慰剂治疗,贝派地酸的副作用在两项Ⅲ期临 床 研 究 (CLEAR Harmony 研 究 和 CLEAR Wisdom研究)中均有报道,包括:
-
上呼吸道感染(贝派地酸组对安慰剂组:4.5%对 4.0%),
-
肌肉痉挛(贝派地酸组对安慰剂组:3.6%对 2.3%),
-
高尿酸血症(贝派 地 酸 组 对 安 慰 剂 组 :2.5% 对1.1%),
-
背痛(贝派地酸组对安慰剂组:3.3%对 2.2%),
-
腹痛或腹部不适(贝派地酸组对安慰剂组:3.1%对 2.2%),
-
支气管炎(贝派地酸组对安慰剂组:3.0% 对 2.5%),
-
四 肢 疼 痛(贝派地酸组对安慰剂组:3.0% 对 1.7%),
-
贫血(贝派地酸组对安慰剂组:2.8%对 1.9% ),
-
肝 酶 升 高(贝派地酸组对安慰剂组:2.1% 对 0.8%)。
美国食品与药物管理局(FDA)2020年2月批准了贝派地酸单药或者联合依折麦布进行治疗,以作为饮食和他汀类药物达到最大耐受剂量时的辅助疗法,用于治疗杂合体家族性高胆固醇血症成年人患者,或者需要进一步降低LDL-C水平的 ASCVD 患者。每日一次,口服剂量180 mg。
欧盟2020年3月批准贝派地酸联合依折麦布进行治疗,适应证为有原发性高胆固醇血症(杂合体家族性/非家族性)或者混合型血脂异常的成年人患者,并且在同年4月批准了贝派地酸可以作为单药治疗使用。
4针对血脂管理新靶标的药物及疗法
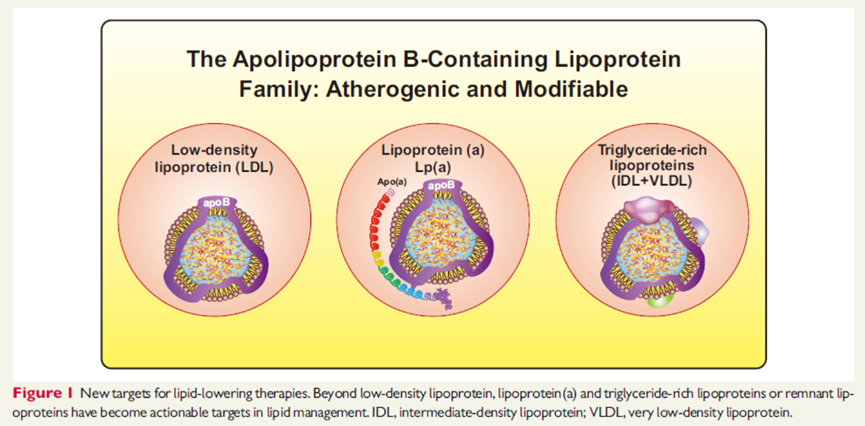
临床中测定的 TG 针对的是包含残余脂蛋白在内的富含TG脂蛋白家族的生物标志物,包括乳糜微粒残留物、极低密度脂蛋白(VLDL)和中间密度胆固醇(IDL)。富含TG脂蛋白家族导致动脉粥样硬化可能与其转运胆固醇以促进泡沫细胞形成有关,而非颗粒内的甘油三酯含量。
人类遗传学研究重新关注了富含TG脂蛋白在ASCVD中的因果作用。与微血管内皮细胞表面相关的脂蛋白脂肪酶(LPL)可以从 TG 中释放出游离脂肪酸而降低 TG的浓度,因此,TG 的水平在很大程度上取决于LPL的活性。LPL活性遗传变体降低会导致富含 TG 的脂蛋白颗粒水平升高。
人类遗传学研究表明,遗传性变异增强了LPL抑制剂的作用,包括脂蛋白C-Ⅲ、ANGPTL 3和4,导致这些患者的心血管事件持续增加。另一方面,脂蛋白活性增强的患者,LPL 活性也会增强,从而降低了心血管事件的风险,而损耗LPL功能的自身突变会增加心血管事件的风险。
对富含TG脂蛋白在动脉粥样硬化中因果作用的重新评估,有利于临床干预措施的发展。
目前,减少脂蛋白C-Ⅲ和抑制ANGPTL 3和4的药物正在进行临床评估。
现在已有越来越多的人认识到富含 TG 的脂蛋白在动脉粥样硬化中的作用,一些指南也建议将非 HDL-C 作为治疗的次要靶点。
除了 LDL 颗粒,现在认为含有残余胆固醇的非HDL-C 也会导致动脉粥样硬化。Apo B测量可以涵盖所有致动脉粥样硬化的脂蛋白种类,并与人群中的非 HDL-C有很好的相关性,但目前并非所有机构都能开展相关检测。
针对Lp(a)的降脂疗法
Lp(a)是一种特殊形式的LDL,由Apo(a) 与环绕LDL颗粒的标志性蛋白Apo B共价结合。
许多观察性研究显示,Lp(a)升高与心血管风险的增加有关。多项人类遗传学研究已经确定,Lp(a)不仅存在于ASCVD患者中,与主动脉瓣钙化疾病也有关系。
由于个体Lp(a)水平随时间变化不大,目前一些指南建议,所有人一生中应检测一次Lp(a)。
对于不明原因的早发ASCVD事件、同时伴有钙化性主动脉狭窄、有Lp(a)升高或早发心血管疾病家族史的患者,以及对他汀类药物降低LDL-C反应不佳的患者,均需要评估Lp(a)的浓度。
传统降低LDL的药物对Lp(a)的影响很小或几乎没有影响,只有抗PCSK9抗体能够轻度降低Lp(a)水平。RNA技术的进步促进了肝细胞靶向反义寡核苷酸或siRNA制剂的发展,如pelacarsen和olpasiran可以显著降低Lp(a)浓度、
随着人口老龄化和主动脉瓣钙化疾病的增加,降低Lp(a)以预防或改善Lp(a)升高患者的主动脉瓣硬化或狭窄的相关研究仍是重中之重。
Evinacumab
ANGPTL 3通过抑制LPL和内皮脂肪酶(EL)升高血浆中TG、LDL-C和HDL-C的水平。抑制ANGPTL 3表达即能保持EL和LPL的活性,从而起到调脂作用。
Evinacumab是一类重组人单克隆抗体,主要通过抑制ANGPTL 3的表达降低TG和LDL-C 。
ANGPTL 3 降低 LDL 的 作 用 依 赖 于VLDL 受体,而非 LDL 受体 。因 此 ,缺乏有效性LDL受体的纯合子家族性高胆固醇血症患者对提高VLDL受体水平的药物反应不佳。但Ⅲ期临床研究(ELIPSE HoFH 研究)发现,evinacumab可将LDL-C水平在稳定降脂治疗的基础上进一步降低约47%。
基于此,FDA在2021年2月批准evinacumab用于12岁及以上纯合子家族性高胆固醇血症成年人和儿童患者的辅助治疗。
反义寡核苷酸药物
Volanesorsen 是一种靶向载脂蛋白 C-Ⅲ的反义寡核苷酸药物,可通过 GalNAc 靶向作用于肝细胞,抑制 ANGPTL 3 合成,既能提高富含TG的脂蛋白水平,也可以发挥独立的促炎作用。
在高乳糜微 粒 血 症 的 患 者 中 ,volanesorsen可将TG水平降低 70%以上,但近四分之一的患者出现了注射部位反应。
纤维酸衍生物
纤维酸衍生物也具有调节血脂的作用,其通过刺激过氧化物酶体增殖物激活受 体 α(PPARα)来提高HDL-C,降低TG。培美贝特是一种新型的选择性PPARα调节剂,可降低TG和脂蛋白C-Ⅲ,目前一项相关大规模的临床研究(PROMINENT研究)正在进行中。
小结
总体来说,大量靶向新途径和致病性脂蛋白的治疗措施正在蓬勃发展。他汀类药物目前仍然是临床上首选的基础降脂药物。随着临床研究证据的充实,进一步确定新型降脂疗法改善心血管事件结局的功能,相信ASCVD患者会有更多治疗选择,血脂管理治疗方案的个体化定制也会更加容易实现。
参考文献:
[1]Tokgözoğlu L, Libby P. The dawn of a new era of targeted lipid-lowering therapies. Eur Heart J. 2022 Jan 20:ehab841.
[2] 王琦,邹云增,冠心病降脂治疗新进展。中国临床药理学与治疗学,2022, 4.
[3]Dayar E, Pechanova O. Targeted Strategy in Lipid-Lowering Therapy. Biomedicines. 2022 May;10(5):1090.
END
来源:中国医学论坛报今日循环
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#生物技术#
85
认真学习~~
63