Nature:揭示MYC的致癌之谜
2015-05-19 佚名 生物通
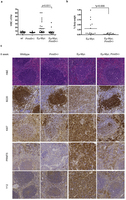
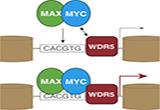
根据新加坡科技研究局(A*STAR)的一项最新研究工作,称作为MYC的广泛致癌蛋白部分程度上是通过确保RNA转录物正确拼接,促进了肿瘤细胞的生长。阻断细胞剪接机器组成元件的一些药物,或许可以提供一条的新途径来阻止MYC驱动的癌症增殖。他们的研究结果发布在5月11日的《自然》(Nature)杂志上。研究的领导者、A*STAR分子和细胞生物学研究所Ernesto Guccione说:“过表达癌基因MY
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#Nat#
54
参考参考。
126
#MYC#
60
#致癌#
64