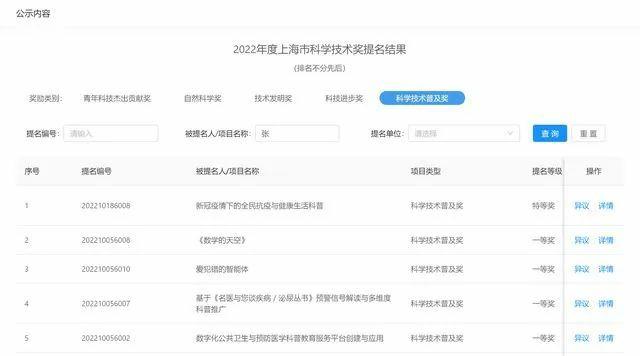
尽管目前这类药物可能在中国首发还是比较少,但随着我国“First-in-Class”医院和“First-in-Class”企业的不断发展与完善,未来大概率会实现越来越多的“First-in-Class”药物在中国的首发。
中国的生物医药能否打造世界级的“First-in-Class”?到底该如何正确地实现科技创新?又该怎样合理地完成市场转化?创新药研发困难重重,收益对应着风险。一些企业偏重“First in Class”,一些企业偏重“Fast Follow”。
1、"First-in-class"
根据FDA定义, 被授予First-in-class资格的药物是指一种使用全新的、独特的作用机制来治疗某种疾病的药物。随着数十年的药物开发,众多传统疾病领域已有成熟的药物占领市场,研发的重点从传统领域,转移到新兴科学或能够开辟新机遇的治疗领域,而不再试图在这些传统治疗领域上进行渐进式改进,意味着我们不得不将目光重新看向“曾经的荒原”。
新技术的发展及验证也促进了FIC发现。在医药行业不断更新迭代中,CAR-T疗法,CRISPR技术,DNA编码化合物库技术,PROTAC技术及人工智能等为药物发现的新增长点奠定基础,使得概念性的治疗方案逐渐落地应用,开拓以往无法开拓的领域。据不完全统计,1999-2018的20年里FDA共批准620个新药,而被授予First-in-class资格的仅为194个(FIC/新药总数=31.3%)。
一个原创新药的研发,从研发立项到成功推入市场,坊间流传有“双十”定律,即耗费十亿美元,花费十年时间。2016年塔夫茨研究所(Tufts Center)数据显示,包含沉默成本的原创新药研发平均成本高达26亿美元。资金和时间难以为继是“First in Class”药企难以成功的主要原因之一。理论上,在技术到位的基础上,如果资金和时间足够充足,即使前列的管线失败,也能在后期开发出首创药物。大部分的全新机制药物并未进入临床,或是进入临床不久后进展缓慢或停滞,逐渐被新的疗效更好的创新药自然淘汰。
2、陷入了困境
2015年是中国创新药发展史上的重要节点,这一年新药审批的速度大幅提高、仿制药的集采已有风起青萍之势,这股风千回百转,终于吹动了创新药的“研发之帆”,中国创新药启航,但创新并非易事。
在谈及当下中国医药市场发展现状时,国家传染病医学中心主任、复旦大学附属华山医院感染科主任张文宏近日表示,企业的发展和转化往往由市场选择,并具有一定的方向,但是创新本身却并不能被预先设计,也没有既定的方向。当上世纪五十年代沃森和克里克发现DNA双螺旋结构的时候,人们不过是觉得这揭示了生命的结构而已,没有人知道后面会发生什么,更无法预料到未来是否会成长为一个全新的产业。
随着创新药持续火热,越来越多的企业进入创新药赛道,行业竞争加剧的问题不可避免,靶点扎堆、赛道拥挤、内卷严重的行业乱象随之出现。毕马威(KPMG)发布的《2022年中国创新药企发展白皮书》指出,目前中国创新药企受制于研发、商业化与资金三方面压力,陷入困局。
3、以临床价值为导向
目前我国药物创新研发基础还比较薄弱,产品同质化问题较为突出……2021年我国CDE批准的所有化学药IND中,抗肿瘤药物数量占52%;肿瘤三大靶点PDL1、EGFR、PD1扎堆现象依旧明显;诸如肝癌、胃癌、食管癌等疾病死亡率偏高,但国内在研产品数量却相对较少。
无论何时何地,无论是fast-follow还是first-in-class,药物研发有且只有一个核心原则,就是以患者为中心,以临床价值为导向,解决临床未满足需求。在真正的“First-in-Class”药物研发领域,你的投入有多少,创新产生的速度就有多快,通过持续常态化的投入,科技创新才会慢慢浮现,市场需求与转化才会自然而然发生。
现因新冠疫情和地缘风波的原因,全球协作可能受到了不同程度的负面影响,相信中国生物医药行业势必会朝着更加光明的方向发展,博采众长,锐意进取,逐步引进下一个时代的发展潮流。
参考资料:
https://news.yaozh.com/archive/25370.html
https://www.xianjichina.com/news/details_266240.html
https://www.thepaper.cn/newsDetail_forward_20542887
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言